题目内容
【题目】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)某实验小组在实验室模拟上述反应。一定温度下,在2L盛有Fe2O3粉末的恒容密闭容器中通入0.1molCO,5min时生成2.24gFe。5min内有CO表示的平均反应速率是______________mol·L-1min-1;5min时CO2的体积分数为___________;若将此时反应体系中的混合气体通入100mL0.9mol/L的NaOH溶液中,充分反应后所得溶液中离子浓度由大到小的顺序是__________________ 。
(2)上述反应的平衡常数表达式为:K=_______________;下列能说明该反应已经达到平衡状态的是_____________(填序号)。
a.容器内固体质量保持不变
b.容器中气体压强保持不变
c.c(CO)=c(CO2)
d.v正(CO)=v逆(CO2)
(3)已知上述反应的平衡常数K与温度T(单位:K)之间的关系如图所示,其中直线的斜率为-![]() (气体常数R=8.3×10-3kJ·mol-1·K-1)。
(气体常数R=8.3×10-3kJ·mol-1·K-1)。
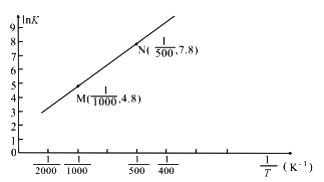
①根据图像可知,该反应的平衡常数随温度升高而____________(填“增大”、“减小”或“不变”)
②该反应的△H=_______________kJ·mol-1。
(4)结合上述有关信息,写出两条提高CO转化率的措施_____________、_______________。
【答案】0.00660%c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)c3(CO2)/c3(CO)ad减小-24.9降低CO2的浓度适当降低温度
【解析】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)n(Fe)=2.24g÷56g/mol=0.04mol,由反应可知消耗CO为0.04mol×![]() =0.06mol,则10min内CO的平均反应速率为v=
=0.06mol,则10min内CO的平均反应速率为v=![]() =0.006 mol/(L·min);将混合气体通入100mL0.9mol/L的NaOH溶液中,完全反应后可得0.03molNaHCO3和0.03molNa2CO3的混合溶液,因水解溶液显碱性,且CO32-的水解程度大于HCO3-,所得溶液中离子浓度由大到小的顺序是 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) ;
=0.006 mol/(L·min);将混合气体通入100mL0.9mol/L的NaOH溶液中,完全反应后可得0.03molNaHCO3和0.03molNa2CO3的混合溶液,因水解溶液显碱性,且CO32-的水解程度大于HCO3-,所得溶液中离子浓度由大到小的顺序是 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) ;
(2)由Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),纯固体不能代入K的表达式中,则该反应的化学平衡常数表达式为K=
2Fe(s)+3CO2(g),纯固体不能代入K的表达式中,则该反应的化学平衡常数表达式为K=![]() ;a.容器内固体质量保持不变,能说明是平衡状态,故a正确;b.因容器中气体的总物质的量不变,压强保持不变无法说明是平衡状态,故b错误;c.c(CO)=c(CO2) 无法说明是平衡状态,故c错误;d.当v正(CO)=v逆(CO2) 时能说明是平衡状态,故d正确;故答案为ad;
;a.容器内固体质量保持不变,能说明是平衡状态,故a正确;b.因容器中气体的总物质的量不变,压强保持不变无法说明是平衡状态,故b错误;c.c(CO)=c(CO2) 无法说明是平衡状态,故c错误;d.当v正(CO)=v逆(CO2) 时能说明是平衡状态,故d正确;故答案为ad;
(3)①根据图像可知,lnK随![]() 增大而增大,而温度越高,
增大而增大,而温度越高,![]() 越小,则该反应的平衡常数随温度升高而减小;
越小,则该反应的平衡常数随温度升高而减小;
②设直线与纵轴交点的纵坐标是b,则有lnK= -![]() ·
·![]() +b,将M、N两点的坐标数值代入求得b=1.8,则有4.8= -
+b,将M、N两点的坐标数值代入求得b=1.8,则有4.8= -![]() +1.8,解得△H=-24.9kJ·mol-1;
+1.8,解得△H=-24.9kJ·mol-1;
(4)此反应正方向为放热反应,可以通过 降低CO2的浓度或适当降低温度,使平衡正向移动,达到提高CO转化率的目的。


