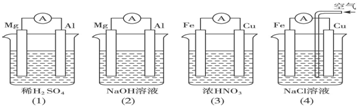
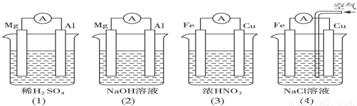
题目内容
分析如图所示的四个装置,结论正确的是( )
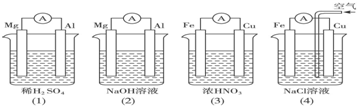

分析:当稀硫酸是电解质溶液时,Mg作负极(活泼性Mg>Al);当NaOH是电解质溶液时,Al作负极(Mg不与NaOH溶液反应);(3)中Cu作负极,反应式为:Cu-2e-=Cu2+,Fe作正极,因为常温下,Fe被浓硝酸钝化,(4)中Cu作正极,电极反应式为:2H2O+O2+4e-=4OH-,以此解答该题.
解答:解:A.(2)中Mg不与NaOH溶液反应,Mg作负极,(3)中因为常温下,Fe被浓硝酸钝化,Cu作负极,故A错误;
B.当NaOH是电解质溶液时,Al作负极(Mg不与NaOH溶液反应),Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑,故B正确;
C.(4)中正极反应式为2H2O+O2+4e-=4OH-,负极反应式为Fe-2e-=Fe2+,没有气泡产生,故C错误;
D.(4)中Cu作正极,发生吸氧腐蚀,正极反应式为:2H2O+O2+4e-=4OH-,故D错误.
故选B.
B.当NaOH是电解质溶液时,Al作负极(Mg不与NaOH溶液反应),Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑,故B正确;
C.(4)中正极反应式为2H2O+O2+4e-=4OH-,负极反应式为Fe-2e-=Fe2+,没有气泡产生,故C错误;
D.(4)中Cu作正极,发生吸氧腐蚀,正极反应式为:2H2O+O2+4e-=4OH-,故D错误.
故选B.
点评:本题考查原电池的正、负极的判断及电极反应式的书写,电解质溶液不同,导致两极发生改变,考查学生知识的变迁能力和灵活应变能力,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
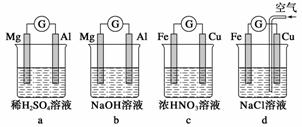
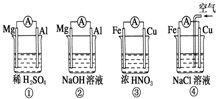 分析如图所示的四个原电池装置,其中结论正确的是( )
分析如图所示的四个原电池装置,其中结论正确的是( )