题目内容
现有一份单质铁和氧化铁的混合物,其物质的量共a mol,加入一定量的盐酸后固体全部溶解,收集到b mol氢气。下列有关叙述中正确的是
| A.反应后的溶液中加入氯水不变色 |
| B.反应后的溶液可继续溶解金属铜 |
C.原混台物中氧化铁的物质的量为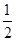 (a-b)mol (a-b)mol |
| D.原混合物中单质铁的物质的量为b mol |
C
解析试题分析:A、铁离子的氧化性强于氢离子,所以混合物溶于水铁首先与反应中生成的氯化铁反应生成氯化亚铁,然后再与盐酸反应生成氢气。溶液是氯化亚铁溶液,亚铁离子具有还原性,所以反应后的溶液中加入氯水生成铁离子,溶液颜色变化,A不正确;B、氯化亚铁与铜不反应,因此B不正确;C、根据电子转移守恒,与H+反应生成H2的铁的物质的量等氢气的物质的量,即n(Fe)=n(H2)=bmol;其余的铁则和Fe2O3以等物质的量溶于盐酸生成FeCl2,即Fe+Fe2O3+6H+=3Fe2++3H2O,参加该反应的铁与氧化铁的物质的量为均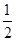 (a-b)mol,C正确;D、共含铁bmol+
(a-b)mol,C正确;D、共含铁bmol+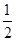 (a-b)mol=
(a-b)mol=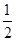 (a+b)mol,D不正确,答案选C。
(a+b)mol,D不正确,答案选C。
考点:考查铁与氧化铁的混合物溶液溶于盐酸的有关计算与判断

练习册系列答案
相关题目
工业用洗净的废铜作原料来制备硝酸铜。为了节约原料和防止污染,宜采取的方法是
A.Cu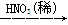 Cu(NO3)2 Cu(NO3)2 |
B.Cu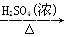 CuSO4 CuSO4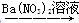 Cu(NO3)2 Cu(NO3)2 |
C.Cu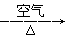 CuO CuO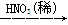 Cu(NO3)2 Cu(NO3)2 |
D.Cu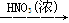 Cu(NO3)2 Cu(NO3)2 |
X、Y、Z分别是三种常见的金属或非金属单质, M、N、R是常见的三种氧化物。其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):(1)X+Z→N;(2)M+X→N;(3)M+Y→R+X 。若X是非金属,则组成Y单质的元素在周期表中的位置是( )
| A.第二周期ⅣA族 | B.第三周期ⅡA族 |
| C.第二周期ⅥA族 | D.第三周期ⅣA族 |
属于联合制碱法优点的是( )。
| A.氨和二氧化碳由合成氨厂提供 | B.母液可回收氯化铵 |
| C.氯化钠的利用率达90%以上 | D.以上全是 |
下列有关铝及其化合物的叙述正确的是( )
| A.铝粉与氧化镁共热可制取金属镁 |
| B.足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气 |
| C.工业上用电解熔融Al2O3的方法冶炼铝 |
| D.在浓硝酸中加入等体积的稀硫酸后,立即加入铝片,铝片表面发生纯化 |
铝用来焊接钢轨是利用( )。
| A.铝同氧气反应生成稳定的保护层 |
| B.铝是热的良导体 |
| C.铝是强还原剂,铝热反应放热 |
| D.铝合金强度大 |
等质量的镁在足量的(1)O2、(2)N2、(3)CO2、(4)空气中燃烧,生成固体物质的质量从大到小顺序正确的是( )
| A.(1)(2)(3)(4) | B.(1)(2)(4)(3) | C.(2)(3)(4)(1) | D.(3)(1)(4)(2) |
下列有关金属及其化合物的说法正确的是 ( )。
| A.Mg和Al都可以用电解法冶炼得到 |
| B.Na2O2、Na2O组成元素相同,与CO2反应产物也相同 |
| C.用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3 |
| D.Mg和Fe在一定条件下与水反应都生成H2和对应的碱 |