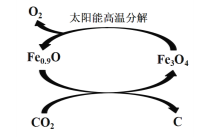
题目内容
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是:
A 反应①的正反应是吸热反应
B 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C 达平衡(I)时,X的转化率为5/11
D 在平衡(I)和平衡(II)中,M的体积分数相等
【答案】C
【解析】
试题分析:降温后达平衡(Ⅱ),隔板左边体系体积减小,说明反应①中平衡向正反应方向移动,故正反应为放热反应,A错误;已知反应②反应前后气体的物质的量不变。恒温达平衡(Ⅰ)时, 隔板左右两边体系压强相同, 由阿伏加德罗定律得n(①)/n(②)=V(①)/V(②), 反应①达平衡(Ⅰ)时气体的物质的量为: n(①)=2×2.8/2.2 mol=28/11 mol, 达平衡(Ⅰ)时体系气体的总物质的量为: 28/11 mol+2 mol=50/11 mol, 由阿伏加德罗定律知平衡(Ⅰ)与反应开始时体系的压强之比为50/11∶5=10∶11, B错误;由题意得:
X(g) + 2Y(g)![]() 2Z(g)
2Z(g)
反应前 1 mol 2 mol 0
变化量 α mol 2α mol 2α mol
平衡(Ⅰ)(1-α)mol (2-2α)mol 2α mol
1-α+2-2α+2α=28/11,解得α=5/11,C正确;平衡(Ⅰ)与平衡(Ⅱ)温度不同,平衡状态一定不同,M的体积分数不相等,D错误。答案选C。

练习册系列答案
相关题目