题目内容
16.下列各组化合物中,不属于同分异构体的是( )| A. | 乙醛、乙酸 | B. | 甲酸乙酯、丙酸 | ||
| C. | CH3CH2CHO、CH3COCH3 | D. | CH3CH2CH2OH、CH3OCH2CH3 |
分析 同分异构体是指分子式相同,但结构不同的化合物,以此来分析解答.
解答 解:A、乙醛、乙酸分子式不同,不是同分异构体,故A选;
B、甲酸乙酯与丙酸,分子式相同,属于同分异构体,故B不选;
C、CH3CH2CHO、CH3COCH3,分子式相同,属于同分异构体,故C不选;
D、CH3CH2CH2OH、CH3OCH2CH3,分子式相同,属于同分异构体,故D不选,
故选A.
点评 本题考查了同分异构体判断,难度不大,注意同分异构体的条件是解题的关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
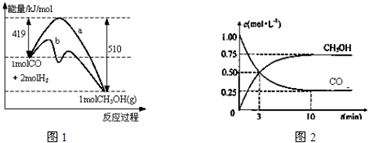
5. 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
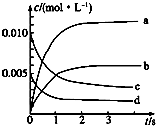
(1)如图表示NO2的浓度变化的曲线是b.用O2表示从0~2s内该反应的平衡速率v=1.5×10-3mol•L-1•s-1.
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
6.某化学小组准备用环己醇制备环己烯,查得相关资料如下.反应原理: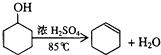
反应物与产物的物理性质:
(1)实验过程中可能发生的有机副反应的方程式为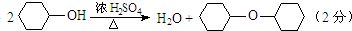 .
.
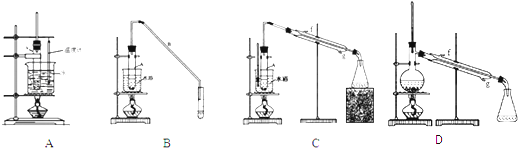
(2)根据上述资料,装置(A,B,C)C最适宜用来完成本次制备实验.
(3)制备粗产品
将5mL环己醇加入试管A中,再加入l0mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是除去环己烯中少量酸性杂质;分液时,环己烯应从分液漏斗的上(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的蒸馏烧瓶(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为85℃.

反应物与产物的物理性质:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 .
.(2)根据上述资料,装置(A,B,C)C最适宜用来完成本次制备实验.

(3)制备粗产品
将5mL环己醇加入试管A中,再加入l0mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是除去环己烯中少量酸性杂质;分液时,环己烯应从分液漏斗的上(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的蒸馏烧瓶(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为85℃.
 .
.
 .
. .
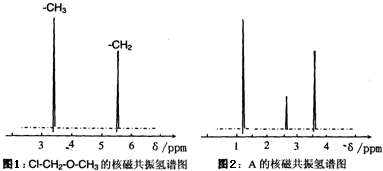
.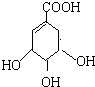 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图: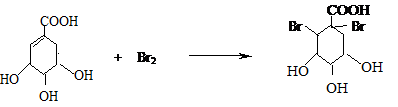 .
.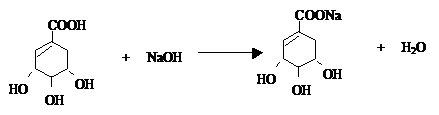 .
.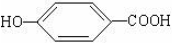 ),其反应类型消去反应.
),其反应类型消去反应.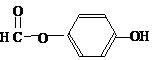 或
或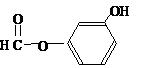 或
或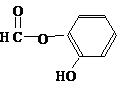 .
.