题目内容
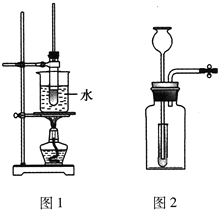
实验室用如图Ⅰ所示的装置制取干燥的氨气.
(1)写出A处NH4Cl和Ca(OH)2反应的化学方程式:
(2)为收集到干燥的氨气C应接
(3)为了检验氨气是否集满,可将
(4)将充满氨气的C试管管口向下倒拿着放入水槽的水中(如图Ⅱ),将拇指稍移开试管口,可观察到
(5)在D、E、F三种气体收集方法中,能用于收集乙烯气体的是
分析:(1)A处NH4Cl和Ca(OH)2反应生成氨气、水和氯化钙;
(2)氨气是极易溶于水的比空气轻的气体,收集应选用向下排气法收集;
(3)依据氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝检验是否集满;
(4)氨气极易溶于水分析;
(5)乙烯是比空气轻的难溶于水的气体,氯气是可溶于水的比空气重的气体,分析选择选择收集装置.
(2)氨气是极易溶于水的比空气轻的气体,收集应选用向下排气法收集;
(3)依据氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝检验是否集满;
(4)氨气极易溶于水分析;
(5)乙烯是比空气轻的难溶于水的气体,氯气是可溶于水的比空气重的气体,分析选择选择收集装置.
解答:解:(1)A处NH4Cl和Ca(OH)2加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)氨气是极易溶于水的比空气轻的气体,收集应选用向下排气法收集,装置中E符合,故答案为:E;
(3)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝证明集满或蘸有浓盐酸的玻璃棒,冒白烟,
故答案为:湿润的红色石蕊试纸,试纸变蓝或蘸有浓盐酸的玻璃棒,冒白烟;
(4)氨气极易溶于水,倒扣在水中,水会充满试管,故答案为:试管中充满水;
(5)乙烯是比空气轻的难溶于水的气体,可以用排水法收集,选择D装置收集;氯气是可溶于水的比空气重的气体,可以选择向上排气法收集,选择F收集装置,
故答案为:D;F.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)氨气是极易溶于水的比空气轻的气体,收集应选用向下排气法收集,装置中E符合,故答案为:E;
(3)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝证明集满或蘸有浓盐酸的玻璃棒,冒白烟,
故答案为:湿润的红色石蕊试纸,试纸变蓝或蘸有浓盐酸的玻璃棒,冒白烟;
(4)氨气极易溶于水,倒扣在水中,水会充满试管,故答案为:试管中充满水;
(5)乙烯是比空气轻的难溶于水的气体,可以用排水法收集,选择D装置收集;氯气是可溶于水的比空气重的气体,可以选择向上排气法收集,选择F收集装置,
故答案为:D;F.
点评:本题考查了氨气的实验室制备方法,氨气性质的分析,主要是收集方法的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
2011年12月13日,加拿大正式宣布将退出《京都议定书》,这使CO2的排放问题再次成为了热点.当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇.其流程如图1所示:
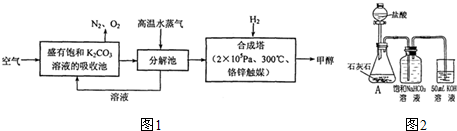
①上述流程中碳酸钾溶液所起的作用是________.
②在分解池中发生的反应为________(写出化学方程式).
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业,可用作气体吸附剂,干粉灭火剂,橡胶防老剂等.
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:
CO2(过量)+OH-═HCO3- HCO3-+OH-═CO32-+H2O
CO32-与H+反应生成CO2分两步:
CO32-+H+═HCO3-; HCO3-+H+═H2O+CO2↑
①小王同学在实验室用如图2所示的装置和药品制取K2CO3溶液.他所制得的溶液中可能含有的杂质是________.
②现有100ml氢氧化钾溶液,请你设计一方案,使其尽可能完全转化为碳酸钾溶液(只需列出实验步骤)________.
③该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50ml硫酸,测得如下数据:
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |

 下列有关实验原理或操作正确的是( )
下列有关实验原理或操作正确的是( ) 下列有关实验原理或操作正确的是
下列有关实验原理或操作正确的是