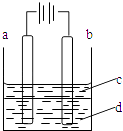
��Ŀ����
����Ŀ���ݱ�����Ħ��������˾������һ���Լ״�Ϊԭ�ϣ���KOHΪ����ʵ������ֻ��Ŀɳ��ĸ�Чȼ�ϵ�أ���һ�ε������ʹ��һ���£���ͼ��һ���绯ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O����գ�
2K2CO3+6H2O����գ�
��1�����ʱ����ԭ��صĸ������Դ���������������ĵ缫��ӦʽΪ ��
��2���ŵ�ʱ�������ĵ缫��ӦʽΪ ��
��3���ڴ˹���������ȫ��Ӧ���ҳ���A������������648g����׳�������������O2L����״���£���
��4�����ڳ��³�ѹ�£�1gCH3OHȼ������CO2��Һ̬H2Oʱ����22.68kJ����ʾ�÷�Ӧ���Ȼ�ѧ����ʽΪ ��
���𰸡�
��1������4OH����4e��=2H2O+O2��
��2��CH3OH+8OH����6e��=CO32��+6H2O
��3��33.6
��4��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=��1451.52kJ/mol
����������1�����ʱ��ԭ��ظ������Դ��������������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��4OH����4e���T2H2O+O2�������Դ�Ϊ������4OH����4e���T2H2O+O2������2���ŵ�ʱ���״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ�����Ե缫��ӦʽΪ��CH3OH��6e��+8OH���TCO32��+6H2O��
���Դ�Ϊ��CH3OH��6e��+8OH���TCO32��+6H2O����3���ҳ���B���������ӵõ��ӷ�����ԭ��Ӧ�����ҳ���B������������648g����׳�������������O2���= ![]() =33.6L��
=33.6L��
���Դ�Ϊ��33.6����4��n��CH3OH��= ![]() mol������CO2��Һ̬H2Oʱ����22.68kJ����2molCH3OHȼ�շų�������Ϊ2��22.68kJ��32=1451.52kJ��
mol������CO2��Һ̬H2Oʱ����22.68kJ����2molCH3OHȼ�շų�������Ϊ2��22.68kJ��32=1451.52kJ��
��Ӧ���Ȼ�ѧ����ʽΪ2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=��1451.52kJ/mol��
���Դ�Ϊ��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=��1451.52kJ/mol��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�