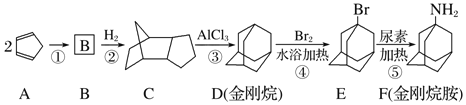
题目内容
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
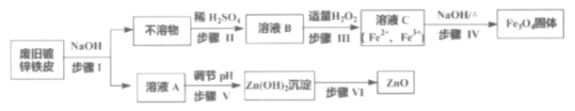
已知反应:①Zn+2NaOH=Na2ZnO2+H2↑②Zn(OH)2+2NaOH=Na2ZnO2+2H2O
回答下列问题:
(1)步骤I中的分离操作名称是_______,溶液A中的溶质有_______(填化学式)。
(2)步骤Ⅲ中反应的离子方程式是___________________________________。
(3)证明溶液B中含有Fe2+的方法是_________________________________。
(4)步骤Ⅴ可选用的试剂是_______(填序号)。
a. NaOH溶液 b. 氨水 c. 盐酸
(5)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH- →Fe3O4(胶体)+S4O62-+H2O,若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。
【答案】过滤 Na2ZnO2、NaOH 2Fe2++2H++H2O2=2Fe3++2H2O 取少量样品于试管中,加入KMnO4溶液,如果KMnO4溶液紫红色褪去,则说明有Fe2+;如果没有褪色,则说明没有Fe2+ c 22.4
【解析】
废旧镀锌铁皮中含有Zn和Fe,依据Zn能与NaOH溶液反应,Fe不与NaOH反应,废旧镀锌铁皮中加入NaOH溶液,然后过滤,不溶物为Fe,溶液A为Na2ZnO2和过量NaOH,不溶物中加入稀硫酸,发生反应Fe+H2SO4=FeSO4+H2↑,溶液B中加入适量的H2O2,部分Fe2+被氧化成Fe3+,然后依此分析即可;
(1)根据流程,步骤I得到不溶物和溶液A,即步骤I的名称为过滤,Zn能与NaOH溶液反应,生成Na2ZnO2,以及所加NaOH过量,即溶液A中溶质为Na2ZnO2和NaOH;
(2)步骤Ⅲ加入适量的H2O2,H2O2将Fe2+氧化成Fe3+,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;
(3)证明Fe2+存在的方法利用Fe2+具有还原性,能使酸性高锰酸钾溶液褪色,具体操作是取少量样品于试管中,加入KMnO4溶液,如果KMnO4溶液紫红色褪去,则说明有Fe2+;如果没有褪色,则说明没有Fe2+;
(4)步骤V,调节pH,使Na2ZnO2转化成Zn(OH)2,利用NaAlO2与酸反应生成Al(OH)3沉淀,即Na2ZnO2和酸反应生成Zn(OH)2沉淀,故选项c正确;
(5)根据反应方程式,Fe2+→Fe3O4,+2价Fe→+3价,S2O32-→S4O62-中S的化合价由+2价→+2.5价,产生Fe3O4与S4O62-均为1mol,失去电子共4mol,根据得失电子数目守恒,参加反应的O2为1mol,即标准状况下的体积为22.4L。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案