题目内容
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,
下列说法正确的是( )
下列说法正确的是( )
| A.起始时盐酸和醋酸溶液PH相同 |
B.V(NaOH)=10.00 mL 时,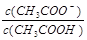 <1 <1 |
| C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多 |
| D.V(NaOH)="20" .00 mL 时,c(Cl?)>c(CH3COO—) |
D
试题分析:A.盐酸和醋酸溶液的物质的量浓度相同,但是由于HCl是强酸,完全电离,CH3COOH是弱酸,部分电离,起始时盐酸和醋酸溶液PH不相同。错误。B.V(NaOH)=10.00 mL 时溶液为CH3COOH和CH3COONa等浓度的混合溶液。溶液中由于CH3COOH的电离作用大于CH3COO-的水解作用,所以
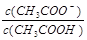 >1.错误。C.由于醋酸是弱酸,与NaOH反应得到的CH3COONa会发生水解发生消耗水电离产生的H+,使溶液显碱性。所以为了使溶液的pH=7,加入的NaOH就应该比强酸HCl要少些。错误。D.V(NaOH)="20" .00 mL 时,根据物料守恒可得c(Na+)=c(Cl?)=c(CH3COO—)+c(CH3COOH)。所以c(Cl?)>c(CH3COO—)。正确。
>1.错误。C.由于醋酸是弱酸,与NaOH反应得到的CH3COONa会发生水解发生消耗水电离产生的H+,使溶液显碱性。所以为了使溶液的pH=7,加入的NaOH就应该比强酸HCl要少些。错误。D.V(NaOH)="20" .00 mL 时,根据物料守恒可得c(Na+)=c(Cl?)=c(CH3COO—)+c(CH3COOH)。所以c(Cl?)>c(CH3COO—)。正确。
练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)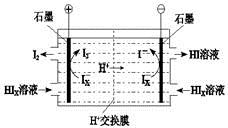 (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: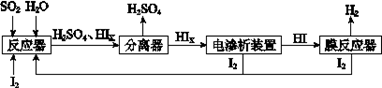
 =1×10-12,下列说法中正确的是
=1×10-12,下列说法中正确的是 H++A-
H++A-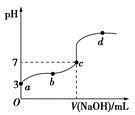
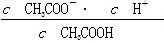 相等
相等
 )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)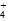 )
)
 2CO(g) ΔH="-221" kJ·mol-1
2CO(g) ΔH="-221" kJ·mol-1