题目内容
【题目】汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ==2xCO2+N2
当转移电子物质的量为0.8x mol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入2 mol CO和6 mol H2
(2)一定条件下,CO与H2可合成甲烷,反应方程式为CO(g)+3H2(g)![]() CH4 (g)+H2O(g)
CH4 (g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 。
②已知H2(g)、CO(g)、和CH4 (g)的燃烧△H分别等于aKJ/mol和cKJ/mol,写出CO与H2反应生成CH4和CO2的热化学方程式: 。
(3)甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
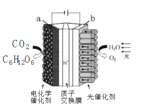
(4)CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为 。

【答案】
I.2.24L
II.(1)①K=![]() ;②BD
;②BD
(2)①该反应H<0
②2CO(g)+2H2(g) ![]() CO2(g)+CH4(g) ΔH=(2a+2b-c)KJ/mol
CO2(g)+CH4(g) ΔH=(2a+2b-c)KJ/mol
(3)AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O
(4)Cu+2Fe+4O2--8e-=CuFe2O4
【解析】
试题分析:I.反应2xCO+2NOx═2xCO2+N2中,NOx中N的化合价为+2x,生成1molN2电子转移为:2(2x-0)=4xmol电子,当转移电子物质的量为0.4xmol时,反应生成氮气0.1mol,标准状况下气体体积为0.1mol×22.4L/mol=2.24L;故答案为:2.24;
II.(1)①CO(g)+2H2(g)CH3OH(g)△H<0,反应的平衡常数为:K=![]() ,故答案为:
,故答案为:![]() ;
;
②A.升高温度,平衡逆向进行,甲醇产率减小,故A错误;B.将CH3OH(g)从体系中分离,平衡正向进行,甲醇产率增大,故B正确;C.充入He,使体系总压强增大,分压不变,平衡不动,故C错误;D.再充入1mol CO和3mol H2,反应物浓度增大,平衡正向进行,甲醇产率增大,故D正确;故答案为:BD;
(2)已知H2(g)、CO(g)、和CH4 (g)的燃烧△H分别等于aKJ/mol和cKJ/mol,热化学方程式为:①H2(g)+![]() O2(g)=H2O(l)△H=akJmol-1,②CO(g)+
O2(g)=H2O(l)△H=akJmol-1,②CO(g)+![]() O2(g)=CO2(g)△H=bkJmol-1,③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=ckJmol-1 ,依据盖斯定律②×2+①×2-③得到:2CO(g)+2H2(g)
O2(g)=CO2(g)△H=bkJmol-1,③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=ckJmol-1 ,依据盖斯定律②×2+①×2-③得到:2CO(g)+2H2(g) ![]() CO2(g)+CH4(g) ΔH=(2a+2b-c)KJ/mol,故答案为:2CO(g)+2H2(g)
CO2(g)+CH4(g) ΔH=(2a+2b-c)KJ/mol,故答案为:2CO(g)+2H2(g) ![]() CO2(g)+CH4(g) ΔH=(2a+2b-c)KJ/mol;
CO2(g)+CH4(g) ΔH=(2a+2b-c)KJ/mol;
(3)氯化银与氨水发生络合反应的离子方程式:AgCl+2NH3H2O=Ag(NH3)2++Cl-+2H2O或者AgCl+2NH3=Ag(NH3)2++Cl-,故答案为:AgCl+2NH3H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl-;
(4)CuFe2O4可用电化学方法得到,根据装置图,阳极上铁和铜失去电子被氧化生成CuFe2O4,电极反应式为Cu+2Fe+4O2--8e-=CuFe2O4,故答案为:Cu+2Fe+4O2--8e-=CuFe2O4。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3- | H2PO4- | SO32- | Zn2+ |
培养液浓度/mol·L-1 | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收量最少的离子是
A.Ca2+B.SO32-C.Zn2+D.H2PO4-