题目内容
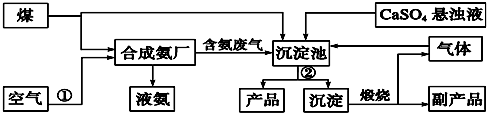
7.锗及其化合物被广泛应用于半导体、催化剂等领域.以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如图1.已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有SiO2、PbO (填化学式),
实验室萃取操作用到的玻璃仪器有分液漏斗、烧杯.
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积 比)的关系如图2所示,从生产成本角度考虑,较适宜的V水相/V有机相的值为8.
(3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).
(4)第⑤步反应的化学方程式GeCl4+(n+2)H2O=GeO2?nH2O+4HCl.
(5)检验GeO2•nH2O是否洗涤干净的操作是取最后一次洗涤液于试管中,往其中加入HNO3酸化的AgNO3溶液,若不产生白色沉淀,则说明洗涤干净.若产生白色沉淀,则说明未洗涤干净.
(6)GeO2产品中通常混有少量SiO2.取样品5.4g,测得其中氧原子的物质的量为0.105mol,则该样品中GeO2的物质的量为0.050 mol.

分析 含锗烟尘中含有ZnO、PbO、CeO2、SiO2,加入稀硫酸过滤,溶解的有ZnO、CeO2,第①步中不溶于稀硫酸的滤渣主要成分有SiO2、PbO,滤液中加入有机萃取剂萃取得到有机层萃取层中加入氢氧化钠进行反萃取得到水层,加入盐酸得到GeCl4,加入纯水过滤得到GeO2•nH2O,加热分解得到GeO2;
(1)根据题目中的流程可以看出第①步中不溶于稀硫酸的滤渣主要成分有SiO2、PbO,实验室萃取操作用到的玻璃仪器有分液漏斗、烧杯.
(2)第③步萃取时,从生产成本角度考虑,由图可知有机萃取剂的用量在V水相/V有机相的值为8时比V水相/V有机相的值为4时少,此时萃取率处于较高水平,而有机萃取剂较贵,故V水相/V有机相的值为8时较适宜.
(3)第④步加入盐酸作用为中和NaOH,作反应物,抑制GeCl4水解.
(4)第⑤步反应GeCl4水解得到氯化氢和GeO2?nH2O;
(5)检验GeO2•nH2O是否洗涤干净的操作是取最后一次洗涤液于试管中,检验是否含有氯离子设计实验验证;
(6)设GeO2的物质的量为xmol,SiO2的物质的量为ymol,依据蒸馏和原子守恒列式计算:2(x+y)=0.105 105x+60y=5.4,解得x=0.050,故该样品中GeO2的物质的量为0.050mol.
解答 解:(1)根据题目中的流程可以看出,含锗烟尘中含有ZnO、PbO、CeO2、SiO2,加入稀硫酸过滤,溶解的有ZnO、CeO2,第①步中不溶于稀硫酸的滤渣主要成分有SiO2、PbO,实验室萃取操作用到的玻璃仪器有分液漏斗、烧杯;
故答案为:SiO2、PbO,分液漏斗、烧杯;
(2)第③步萃取时,从生产成本角度考虑,由图可知有机萃取剂的用量在V水相/V有机相的值为8时比V水相/V有机相的值为4时少,此时萃取率处于较高水平,而有机萃取剂较贵,从生产成本角度考虑,故V水相/V有机相的值为8时较适宜;
故答案为:8;
(3)第④步加入盐酸作用为中和NaOH,作反应物,同时抑制GeCl4水解;
故答案为:中和NaOH,作反应物,抑制GeCl4水解;
(4)第⑤步反应是GeCl4水解得到氯化氢和GeO2?nH2O,反应的化学方程式:GeCl4+(n+2)H2O=GeO2?nH2O+4HCl;
故答案为:GeCl4+(n+2)H2O=GeO2?nH2O+4HCl;
(5)检验GeO2•nH2O是否洗涤干净的操作是:取最后一次洗涤液于试管中,往其中加入HNO3酸化的AgNO3溶液,若不产生白色沉淀,则说明洗涤干净.若产生白色沉淀,则说明未洗涤干净;
故答案为:取最后一次洗涤液于试管中,往其中加入HNO3酸化的AgNO3溶液,若不产生白色沉淀,则说明洗涤干净.若产生白色沉淀,则说明未洗涤干净;
(6)GeO2产品中通常混有少量SiO2.取样品5.4g,测得其中氧原子的物质的量为0.105mol,设GeO2的物质的量为xmol,SiO2的物质的量为ymol,
2(x+y)=0.105
105x+60y=5.4,
解得x=0.050,
故该样品中GeO2的物质的量为0.050mol.
故答案为:0.050.
点评 本题考查了物质分离和提纯的方法和实验设计,实验分析,实验现象的理解,流程和图象的特征分析,物质性质是解题关键,题目难度中等.

| A. | 煤的干馏是物理变化 | |
| B. | 液化石油气和天然气的主要成分都是碳氢化合物 | |
| C. | 石油裂化得到的汽油是纯净物 | |
| D. | 煤的气化和石油的分馏都是物理变化 |
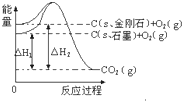
| A. | C(s石墨)=C(s金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 金刚石的稳定性大于石墨 | |
| C. | 石墨和金刚石转化是物理变化 | |
| D. | 1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ |
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Cu | 浓硝酸 | 偏向Al |
(1)实验1、2的Al所作的电极分别是D
A.负极,负极 B.正极,正极 C.负极,正极 D.正极,负极
(2)写出实验5中的电极反应式和电池总反应方程式.
负极Cu-2e-=Cu2+;
正极4H++2NO3-+2e-=2NO2↑+2H2O;
电池总反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
| A. | Y的原子序数比X的小 | B. | Y的原子半径比X的大 | ||
| C. | Y原子的最外层电子数比X的大 | D. | Y元素的最高正价比X的大 |
| A. | 容量瓶、分液漏斗、滴定管在使用府前都需要检杏是否漏水,可以用相同的方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的1/2 | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体一半透膜法分离提纯;悬浊液一过滤分离,本质上就是依椐所分离粒子的直径大小选择具有合适孔径的“筛子” |
| A. | 原子晶体中只存在非极性共价键 | |
| B. | 甲烷?氨和水都是由极性键结合而成的极性分子 | |
| C. | 金属晶体的熔点一定比原子晶体低,比分子晶体高 | |
| D. | H2O的沸点比H2S高,是因为H2O分子间存在氢键 |
 .
.