题目内容
20.化学与生活密切相关,下列说法不正确的是( )| A. | 废塑料制品属于可焚烧处理的垃圾 | |
| B. | 误食重金属离子时,立即喝大量牛奶缓解毒性 | |
| C. | 铁钉在氯化钠溶液中锈蚀的速率比在蒸馏水中的快 | |
| D. | 家用燃料燃烧、烹调和吸烟是室内空气污染物的重要来源 |
分析 A.塑料焚烧时,不但产生大量黑烟,而且会产生迄今为止毒性最大的一类物质:二恶英;
B.依据重金属能够使蛋白质变性解答;
C.氯化钠溶液是强电解质溶液,铁钉在氯化钠溶液中形成原电池反应,铁做负极被腐蚀,蒸馏水是弱电解质,腐蚀速率慢;
D.依据室内空气污染物的重要来源解答.
解答 解:A.塑料焚烧时,不但产生大量黑烟,而且会产生迄今为止毒性最大的一类物质:二恶英,引起二次污染,故A错误;
B.牛奶主要成分是蛋白质,重金属离子能使蛋白质变性,可防止人体本身的蛋白质被破坏,故B正确;
C.铁钉在氯化钠溶液中形成原电池反应,铁做负极被腐蚀,氯化钠是强电解质,蒸馏水是弱电解质,所以氯化钠中腐蚀速率快,故C正确;
D.室内空气污染主要包括:一是室内装修、家具涂料、建筑材料带来的污染物,如甲醛、放射性气体氡等;二是室外流入的污染物,如二氧化硫;三是家庭利用燃料煮食物、取暖等形成的污染物,如油烟,吸烟等,故D正确;
故选:A.
点评 本题考查了空气污染来源,原电池反应原理分析,物质性质的分析应用,化学常识的积累与运用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
10.设NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 标准状况下,2.24 LCCl4中含Cl原子数目大于0.4NA | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
11.海水是一个巨大的化学资宝库,下列有关海水综合利用的说法,正确的是( )
| A. | 海水中含有氢、氧元素,所以可以使用物理方法从海水中得到氢气 | |
| B. | 从海水中可以得到NaCl,电解NaCl溶液可得到金属钠 | |
| C. | 从海水中提取Br2、I2的过程中发生了氧化还原反应 | |
| D. | 海水蒸发制海盐的过程中只发生了化学变化 |
8.在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的措施正确的是( )
| A. | 加催化剂 | B. | 减小反应容器体积 | ||
| C. | 升高温度 | D. | 增大NO浓度 |
15.有人制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.以下判断错误的是( )
| A. | 电池的正极发生的反应:O2+4e-═2O2- | |
| B. | 负极发生的反应:CH4+4O2--8e-═CO2+2H2O | |
| C. | 固体电解质里的O2-的移动方向:由正极流向负极 | |
| D. | 向外电路释放电子的电极:正极(电子由正极流向负极) |
5.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成的氢气总量.可向盐酸中加入适量的( )
| A. | NaOH(s) | B. | HCl(g) | C. | NH4Cl(s) | D. | CH3COONa(s) |
12.图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
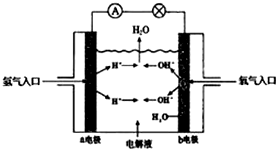

| A. | a电极是正极 | |
| B. | b电极的电极反应为:4OH--4e-=2H2O+O2 | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 氢氧燃料电池是一种具有应用前景的绿色电源 |
9.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )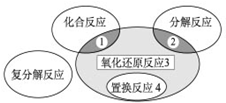

| A. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | D. | Zn+H2SO4═ZnSO4+H2↑ |
10.${\;}_1^1H、$${\;}_1^2H、$${\;}_1^3H、$H+、H2,下列说法正确的是( )
| A. | 具有相同的质子数 | B. | 具有不同的电子数 | ||
| C. | 这些微粒互称同位素 | D. | 它们是氢元素不同的五种微粒 |