题目内容
【题目】氮氧化物(NOx)是大气主要污染物之一,请根据以下方法的选用回答相应问题:
I.利用CH4催化还原氮氧化物消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l) △H=-662kJ/mol
4NO(g)+CO2(g)+2H2O(l) △H=-662kJ/mol
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
其中①式的平衡常数为K1,②式的平衡常数为K2,则:(1) CH4 (g)+4NO (g)=2N2(g) + CO2 (g )+H2O (1)△H=_________ ;改反应的平衡常数K=_________(用含Kl、K2的代数式表示)。
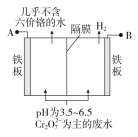
II利用燃料电池的原理来处理氮氧化物是一种新方向。装置如图所示,在处理过程中石墨电极I上反应生成一种氧化物Y。

(2)写出氧化物Y的化学式_____________;
(3)石墨II电极为______(填“正”或“负”)极,该电极反应为______________;
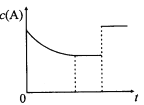
Ⅲ.利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:

(4)该反应的平衡常数表达式K=_______,在0~10s内,N2的平均反应速率为______mol/(L·s),NO的转化率为________;
(5)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
【答案】-1248kJ·mol-1![]() N2O5正O2+4e-+2N2O5=== 4NO
N2O5正O2+4e-+2N2O5=== 4NO![]()
![]() 0.001224%减小CO2的浓度<
0.001224%减小CO2的浓度<
【解析】(1)①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l) △H=-662kJ/mol,
4NO(g)+CO2(g)+2H2O(l) △H=-662kJ/mol,
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
由盖斯定律②×2-①可得:CH4 (g)+4NO (g)=2N2(g) + CO2 (g )+H2O (1)△H =2×(-955kJ/mol)-(-662kJ/mol)=-1248kJ/mol,则K=![]() ,故答案为:-1248kJ/mol;
,故答案为:-1248kJ/mol;![]() ;
;
II 、(2)正极上氧气得到电子与NO3-结合生成N2O5,所以Y的化学式为N2O5,故答案为:N2O5;
(3) 燃料电池中通氧气的为正极,通燃料的为负极,则石墨I极为负极,石墨II极为正极,正极发生还原反应,电极反应为O2+4e-+2N2O5=== 4 NO3-,故答案为:N2O5 ;正;O2+4e-+2N2O5=== 4 NO3-;
Ⅲ. (4)根据C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol,反应的平衡常数表达式K=
N2(g)+ CO2(g) △H=akJ/mol,反应的平衡常数表达式K=![]() ;在0~10s内,N2的平均反应速率为
;在0~10s内,N2的平均反应速率为![]() =0.0012mol/(L·s);NO的转化率为=
=0.0012mol/(L·s);NO的转化率为=![]() ×100%=24%,故答案为:
×100%=24%,故答案为:![]() ;0.0012;24%;
;0.0012;24%;
(5)30s后,NO和CO2的浓度减小,但氮气的浓度增大,表示平衡正向移动,则改变的条件可能是减小CO2的浓度,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,表示平衡逆向移动,说明正反应属于放热反应,则该反应的a<0,故答案为:减小CO2的浓度; <。

 名校课堂系列答案
名校课堂系列答案【题目】从下列事实所列出的相应结论正确的是 ( )
实 验 事 实 | 结 论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->HAlO2或Al(OH)3 |
D | SO2通入KMnO4溶液,溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D