题目内容
设阿伏加德罗常数为NA,下列说法中正确的是( )
分析:A、常温下,温度比标准状况下高,气体摩尔体积大于22.4/mol,22.4LNH3的物质的量小于1mol,NH3与氧气完全反应生成NO,化合价升高5价,1mol氨气完全反应转移5mol电子;
B、二氧化氮能够发生反应:2NO2?N2O4,二氧化氮的分子数减少;
C、阴极被还原得到的是氢气,物质的量是0.5mol,消耗水电离的氢离子1mol,溶液中产生1mol氢氧根离子;
D、SO2和1 molO2 的反应是可逆反应,不可能完全生成三氧化硫.
B、二氧化氮能够发生反应:2NO2?N2O4,二氧化氮的分子数减少;
C、阴极被还原得到的是氢气,物质的量是0.5mol,消耗水电离的氢离子1mol,溶液中产生1mol氢氧根离子;
D、SO2和1 molO2 的反应是可逆反应,不可能完全生成三氧化硫.
解答:解:A、常温下,22.4LNH3的物质的量小于1mol,1mol氨气完全反应生成一氧化氮转移5mol电子,故常温下,22.4LNH3与氧气完全反应生成NO时,转移的电子数小于5NA故A正确;
B、由于存在反应:2NO2?N2O4,标准状况下,46gNO2气体中分子数小于NA个,故B错误;
C、电解饱和食盐水时,阴极析出的是氢气,物质的量是0.5mol,消耗水电离的氢离子1mol,溶液中产生1mol氢氧根离子,PH为14,故C错误;
D、由于二氧化硫和氧气反应生成三氧化硫是可逆反应,反应物不可能完全转化,反应后分子总数一定大于3NA,故D错误;
故选A.
B、由于存在反应:2NO2?N2O4,标准状况下,46gNO2气体中分子数小于NA个,故B错误;
C、电解饱和食盐水时,阴极析出的是氢气,物质的量是0.5mol,消耗水电离的氢离子1mol,溶液中产生1mol氢氧根离子,PH为14,故C错误;
D、由于二氧化硫和氧气反应生成三氧化硫是可逆反应,反应物不可能完全转化,反应后分子总数一定大于3NA,故D错误;
故选A.
点评:本题考查阿伏伽德罗常数,注意可逆反应的特点,本题难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
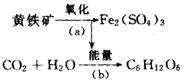 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如氧化亚铁硫杆菌在溶液中能将黄铁矿氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如氧化亚铁硫杆菌在溶液中能将黄铁矿氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下: