题目内容
10.下列反应在通常性情况下可以发生:①2FeCl3+Cu═2FeCl2+CuCl2;②Fe+CuSO4═FeSO4+Cu;③2FeCl3+2KI═2FeCl2+2KCl+I2;④6FeCl2+3Br2═4FeCl3+2FeBr2.则Br2,Fe3+,I2,Fe2+,Cu2+的氧化性强弱顺序是( )| A. | Br2>Fe3+>I2 | B. | Fe3+>Br2>I2 | C. | Br2>I2>Fe3+ | D. | Fe3+>Cu2+>Fe2+ |
分析 根据氧化还原反应中含有元素化合价降低的物质为氧化剂,氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来解答.
解答 解:①中Fe元素的化合价降低,则FeCl3为氧化剂,氧化性Fe3+>Cu2+
②中Cu元素的化合价降低,则CuSO4为氧化剂,氧化性Cu2+>Fe2+,
③中Fe元素的化合价降低,则FeCl3为氧化剂,氧化性Fe3+>I2,
④中Br元素的化合价降低,则Br2为氧化剂,氧化性Br2>Fe3+,
则各粒子氧化性由强到弱的顺序为Br2>Fe3+>Cu2+>Fe2+,Br2>Fe3+>I2,
故选AD.
点评 本题考查氧化性的比较,明确氧化还原反应中氧化剂的判断及氧化性比较的规律即可解答,难度不大,注重了基础知识的考查.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
1.下列有关实验装置进行的相应实验,能达到实验目的是( )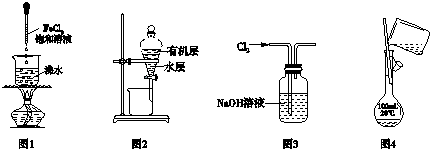

| A. | 用图1制备氢氧化铁胶体,当溶液至红褐色时继续煮沸 | |
| B. | 用图2所示装置分离CCl4萃取碘水后已分层的有机层和水层 | |
| C. | 用图3所示装置除去Cl2中含有的少量HCl气体 | |
| D. | 用图4所示装置配制实验所需100mL0.1mol/LNaCl溶液 |
18.下列叙述,正确的是( )
| A. | 电解质在电流的作用下发生电离 | |
| B. | 存在自由移动的离子是电解质溶液能导电的原因 | |
| C. | 金属铜能导电,所以铜是电解质 | |
| D. | 硫酸氢钠在水溶液中能电离出氢离子,所以硫酸氢钠属于酸 |
5.下列说法中正确的是( )
| A. | 氧化还原反应的本质是元素化合价的升降 | |
| B. | 氧化反应和还原反应必然同时发生 | |
| C. | 氧化反应是指反应中失去电子,所含元素化合价升高,被氧化 | |
| D. | 还原反应在反应中失去电子,所含元素化合价升高,被氧化 |
4.对于下列甲、乙、丙三物质的说法,不正确的是( )

| A. | 等物质的量的甲、乙、丙分别与足量钠反应,乙放出气体最多 | |
| B. | 甲、乙、丙均能与Fe3+显色 | |
| C. | 甲和丙互为同分异构体 | |
| D. | 甲、乙、丙苯环上的一溴代物均为4种 |
11.往10mL 1mol/L AlCl3加入1mol/L NaOH溶液,得沉淀0.39g,则所加氢氧化钠溶液的体积可能为( )
| A. | 5 mL | B. | 25 mL | C. | 35 mL | D. | 45mL |
8.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
| A. | 8NH3+3Cl2═6NH4Cl+N2 | B. | Cl2+2HI═I2+2HCl | ||
| C. | 2Na2O2+2H2O═4NaOH+O2 | D. | Ca(OH)2+2HCl═CaCl2+2H2O |
9.用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 常温常压下,22.4L氧气含分子数为NA个O2 | |
| B. | 1molNa2O2化合物中有2mol阴离子和2mol阳离子 | |
| C. | 2.3g金属钠变为钠离子失去电子数为0.1NA | |
| D. | .常温下,1 L 0.5 mol•L-1 NH4Cl溶液中含有3.01×1023个NH4+ |
 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.