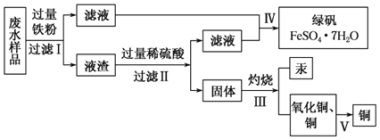
题目内容
【题目】
磷及其化合物是生活生产中重要的组成部分,以下是一些常见的磷的化合物:
(1)与磷同主族、比磷多一个周期的元素基态原子的价层电子排布为___________.
(2)磷与同周期相邻的两种元素的第一电离能由大到小的顺序为__________。(用元素符号表示)。
(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,请画出亚磷酸的分子结构_______。亚磷酸可作还原剂将Cu2+还原为单质,得到的电子填充到________轨道。
(4)己知PBr5晶体中存在PBr4+,和Br-两种离子,则PBr4+,中心P原子杂化类型为___,该离子的几何构型为______。而PCl5晶体中存在PCl4+和另一种阴离子,该阴离子配位数为6,请写出该离子的化学式:______。PBr5晶体中不能形成与PCl5晶体一样的阴离子的原因可能是:_________。
(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图,可以将其看做Si晶体的“广义等电子体”,可做半导体材料.
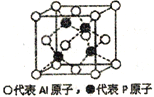
①根据“广义等电子原理”,下列物质中,可能是半导体的有____________.
A. SiC B.CaO2 C. GaAs D.Si3N4 E.BN
②磷化铝中,Al原子的配位数为_______,若该晶胞密度为dg/cm3,用NA表示阿伏伽德罗常数,则该晶体的边长为_______。
【答案】 4s24p3 P>S>Si 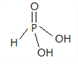 3d、4s sp3杂化 正四面体形 PCl6- Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定 ACE 4
3d、4s sp3杂化 正四面体形 PCl6- Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定 ACE 4 ![]()
【解析】试题分析:(1)与磷同主族、比磷多一个周期的元素是33号元素As;(2)同周期元素从左到右第一电离能逐渐增大,ⅤA族元素P轨道半充满,为稳定结构,第一电离能大于同周期ⅥA族元素;(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,所以H3PO3是二元酸;Cu2+的电子排布式是1s22s22p63s23p63d9,Cu的电子排布式是1s22s22p63s23p63d104s1;(4)PBr4+中P原子的价电子对数是![]() ;磷元素化合价为+5,配位数为6,另一种阴离子带的电荷数是-1;Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定;(5) ①AlP价电子数为8;②根据晶胞示意图分析Al原子的配位数;②根据
;磷元素化合价为+5,配位数为6,另一种阴离子带的电荷数是-1;Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定;(5) ①AlP价电子数为8;②根据晶胞示意图分析Al原子的配位数;②根据![]() 计算晶胞边长。
计算晶胞边长。
解析:(1)与磷同主族、比磷多一个周期的元素是33号元素As,最外层有5个电子,基态原子的价层电子排布为4s24p3;(2)同周期元素从左到右第一电离能逐渐增大,ⅤA族元素P轨道半充满,为稳定结构,第一电离能大于同周期ⅥA族元素,所以磷与同周期相邻的两种元素的第一电离能由大到小的顺序为P>S>Si;(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,所以H3PO3是二元酸,含有2个羟基,H3PO3的结构式是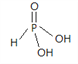 ;Cu2+的电子排布式是1s22s22p63s23p63d9,Cu的电子排布式是1s22s22p63s23p63d104s1,所以得到的电子填充到3d、4s轨道;(4)PBr4+中P原子的价电子对数是
;Cu2+的电子排布式是1s22s22p63s23p63d9,Cu的电子排布式是1s22s22p63s23p63d104s1,所以得到的电子填充到3d、4s轨道;(4)PBr4+中P原子的价电子对数是![]() ,所以P原子杂化类型为sp3;没有孤对电子,所以该离子的几何构型为正四面体形;磷元素化合价为+5,配位数为6,另一种阴离子带的电荷数是-1,该离子的化学式PCl6-;Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定,所以PBr5晶体中不能形成与PCl5晶体一样的阴离子;(5) ①AlP价电子数为8;A. SiC价电子数为8; B.CaO2价电子数为14; C.GaAs价电子数为8; D.Si3N4价电子数为32; E.BN价电子数为8,所以可能是半导体的有ACE;②根据晶胞示意图,Al原子的配位数4;②根据均摊原则,每个晶胞含有Al原子数
,所以P原子杂化类型为sp3;没有孤对电子,所以该离子的几何构型为正四面体形;磷元素化合价为+5,配位数为6,另一种阴离子带的电荷数是-1,该离子的化学式PCl6-;Br原子半径大,P原子周围无法容纳6个Br原子,排斥力太大,不稳定,所以PBr5晶体中不能形成与PCl5晶体一样的阴离子;(5) ①AlP价电子数为8;A. SiC价电子数为8; B.CaO2价电子数为14; C.GaAs价电子数为8; D.Si3N4价电子数为32; E.BN价电子数为8,所以可能是半导体的有ACE;②根据晶胞示意图,Al原子的配位数4;②根据均摊原则,每个晶胞含有Al原子数![]() ,每个晶胞含有P原子数4,所以晶胞的摩尔质量是232g/mol,设晶胞边长是a cm,则晶胞体积为
,每个晶胞含有P原子数4,所以晶胞的摩尔质量是232g/mol,设晶胞边长是a cm,则晶胞体积为![]() ,
, ![]() ,则a=
,则a=![]() 。
。