题目内容
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素。请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(2)Q的元素符号是 ,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,其电子式为 ;其晶体的最小结构单元如图所示,经实验测得FH5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为 cm。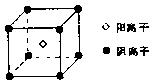
(1)V形(1分)直线形 (1分)SO2(1分)因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大。(2分)
(2)Cr (1分) 1s22s22p63s23p63d54s1 (2分) +6 (1分)
( 3)F-H…F F-H…O O-H…F O-H…O (2分)
(4) NH4H的电子式(略) (2分);  (2分)
(2分)
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
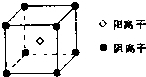 其电子式为
其电子式为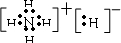
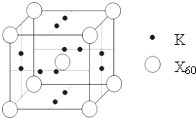 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】