题目内容
6.环己醇( )常用来制取增塑剂和作为工业溶剂.下列说法正确的是( )
)常用来制取增塑剂和作为工业溶剂.下列说法正确的是( )| A. | 环己醇中所有原子可能共平面 | |
| B. | 与环己醇互为同分异构体,且含与醛基(-CHO)的结构有8种(不含立体结构) | |
| C. | 标准状况下,1mol环己醇与足量Na反应生成22.4LH2 | |
| D. | 环己醇的一氯代物有3种(不含立体结构) |
分析 由结构可知含-OH,分子中C均为饱和碳原子,为四面体构型,结合醇的性质来解答.
解答 解:A.分子中C均为饱和碳原子,为四面体构型,所有原子不可能共面,故A错误;
B.与环己醇互为同分异构体,且含与醛基(-CHO)时,烃基为-C5H11,C5H11-的同分异构体有8种同分异构体,则含有醛基(-CHO)的结构有8种,故B正确;
C.含有1个羟基,则标准状况下,1mol环己醇与足量Na反应生成11.2LH2,故C错误;
D.环己醇的一氯代物有5种,环上有4种,甲基1种,故D错误.
故选B.
点评 本题考查有机物的结构及性质,为高频考点,侧重考查学生的分析能力,注意把握结构与性质的关系是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
16.在4Zn+10HNO3═4Zn(NO3)2+NH4NO3+3H2O反应中,被还原的硝酸和未被还原的硝酸的质量之比是( )
| A. | 4:1 | B. | 10:4 | C. | 9:1 | D. | 1:9 |
17.下列与社会、生活有关的说法不正确的是( )
| A. | 减少化石燃料的使用,有利于降低空气中pM 2.5的数值 | |
| B. | 淀粉、豆油、蛋白质都是天然高分子化合物 | |
| C. | 明矾净水和纯碱洗涤油污都是利用了盐的水解 | |
| D. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 |
14. A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的$\frac{1}{4}$,C元素的最高价氧化物的水化物是一种中强碱.甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是( )
A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的$\frac{1}{4}$,C元素的最高价氧化物的水化物是一种中强碱.甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是( )
 A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的$\frac{1}{4}$,C元素的最高价氧化物的水化物是一种中强碱.甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是( )
A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的$\frac{1}{4}$,C元素的最高价氧化物的水化物是一种中强碱.甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是( )| A. | C、D两元素形成化合物属共价化合物 | |
| B. | A、D分别与B元素形成的化合物都是大气污染物 | |
| C. | C、D的简单离子均能促进水的电离 | |
| D. | E的氧化物水化物的酸性大于D的氧化物水化物的酸性 |
1. 如图装置可模拟绿色植物的光合作用,该装置模拟将空气中的H2O和CO2转化为O2和有机物(C3H8O).下列叙述正确的是( )
如图装置可模拟绿色植物的光合作用,该装置模拟将空气中的H2O和CO2转化为O2和有机物(C3H8O).下列叙述正确的是( )
 如图装置可模拟绿色植物的光合作用,该装置模拟将空气中的H2O和CO2转化为O2和有机物(C3H8O).下列叙述正确的是( )
如图装置可模拟绿色植物的光合作用,该装置模拟将空气中的H2O和CO2转化为O2和有机物(C3H8O).下列叙述正确的是( )| A. | x为电源正扱,a电极发生还原反应 | |
| B. | 通电后,质子通过离子交换膜从阴极移向阳极 | |
| C. | 电解开始阶段,阳极区pH逐渐减小 | |
| D. | 当电路中有1mol电子通过时,会有标注状况下2.8 L CO2反应 |
11.下列设计的实验方案能达到相应实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 蛋白质发生了变性 | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然 后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 比较Ksp(BaCO3)、Ksp(BaSO4) | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤, 向洗净的沉淀中加稀盐酸,有气泡产生 |
| D | 通过观察液面差判断该装置的气密性 | 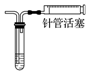 向里推注射器 向里推注射器 |
| A. | A | B. | B | C. | C | D. | D |
18.某有机化合物的结构简式如图所示.下列对该有机物的说法正确的是( )

| A. | 与C10H12O3一定互为同系物 | B. | 能发生酯化、加成、水解等反应 | ||
| C. | 苯环上一硝基取代产物有3种 | D. | 所有碳原子不可能都在同一平面上 |
15.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4•7H2O的过程如图所示:

硼镁泥的主要成分如下表:
回答下列问题:
(1)“酸解”时应该加入的酸是浓硫酸,“滤渣1”中主要含有SiO2(写化学式).
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是氧化亚铁离子、促进铁离子、铝离子转化为沉淀.
(3)判断“除杂”基本完成的检验方法是溶液接近为无色.
(4)分离滤渣3应趁热过滤的原因是温度对硫酸镁、硫酸钙的溶解度影响不同,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙.

硼镁泥的主要成分如下表:
| MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
| 30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时应该加入的酸是浓硫酸,“滤渣1”中主要含有SiO2(写化学式).
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是氧化亚铁离子、促进铁离子、铝离子转化为沉淀.
(3)判断“除杂”基本完成的检验方法是溶液接近为无色.
(4)分离滤渣3应趁热过滤的原因是温度对硫酸镁、硫酸钙的溶解度影响不同,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙.
20.下列实验操作、现象或结论的说法不正确的是( )
| A. | 在沸水中滴加几滴饱和氯化铁溶液,继续煮沸得胶体,再加入Na2SO4溶液,可观察到红褐色沉淀 | |
| B. | 某溶液加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不溶,可确定有SO42-存在 | |
| C. | FeCl2、NaOH、Mg(NO3)2三种溶液不需其他试剂即可鉴别 | |
| D. | 用标准盐酸滴定未知浓度的Na2CO3溶液,可用酚酞作为指示剂 |