��Ŀ����
����Ŀ�����仯������������;��������ʵ������������±���ʾ��

�ش��������⣺
��1����̬Feԭ�Ӽ۲���ӵĵ����Ų�ͼ���������ʽ��Ϊ____����̬Sԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ______�Ρ�
��2�����ݼ۲���ӶԻ������ۣ�H2S��SO2��SO3����̬�����У�����ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���_________��
��3��ͼ��a��ΪS8�Ľṹ�����۵�ͷе�Ҫ�ȶ���������۵�ͷе�ߺܶ࣬��Ҫԭ��Ϊ_____��
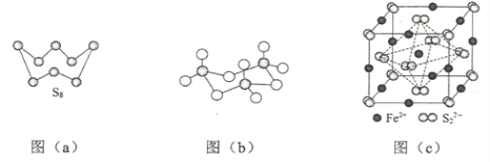
��4����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ_____�Σ����й��ۼ���������_____�֣��������������д�����ͼ��b����ʾ�����۷��ӣ��÷�����Sԭ�ӵ��ӻ��������Ϊ_____��
��5��FeS2����ľ�����ͼ��c����ʾ�������߳�Ϊa nm��FeS2���ʽ��ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ____g��cm3��������Fe2+λ��S22-���γɵ�������������ģ�����������ı߳�Ϊ____nm��1molFeS2�����к���������������Ϊ____
���𰸡�![]() ���� H2S S8���ڷ��Ӿ��壬�۵�ߵ�������Է��������Ĵ�Сֱ����أ���ΪS8����Է���������SO2��Ķ࣬������۷е��SO2������ ƽ�������� 2 sp3�ӻ�
���� H2S S8���ڷ��Ӿ��壬�۵�ߵ�������Է��������Ĵ�Сֱ����أ���ΪS8����Է���������SO2��Ķ࣬������۷е��SO2������ ƽ�������� 2 sp3�ӻ� 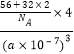 gcm-3
gcm-3 ![]() 2NA
2NA
��������
(1)��̬Feԭ�Ӽ۲����Ϊ��3d��4s�ܼ��ϵ��ӣ���̬Sԭ�ӵ���ռ�ݵ��ܼ���1s��2s��2p��3s��3p������ܼ�Ϊ3p�������������ͼΪ�����Σ�
(2)H2S��Sԭ�Ӽ۲���ӶԸ���=2+![]() =4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+
=4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+![]() =3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+
=3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3��
=3��
(3)S8��SO2�����Ӿ��壬���Ӿ����۷е�������Ӽ������������ȣ����Ӽ�������������Է������������ȣ�
(4)SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹�ͣ��÷�����S-Oԭ��֮����ڹ��ۼ����÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ����ͣ�
=3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹�ͣ��÷�����S-Oԭ��֮����ڹ��ۼ����÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ����ͣ�
(5)�����߳�Ϊanm=a��10-7cm���������=(a��10-7cm)3���þ�����Fe2+����=1+12��![]() =4��S22-����=8��
=4��S22-����=8��![]() +6��
+6��![]() =4���侧���ܶ�=
=4���侧���ܶ�=![]() ��������Fe2+λ��S22-���γɵİ���������ģ�����������ı߳����������ζԽ��ߵij��ȼ��㡣
��������Fe2+λ��S22-���γɵİ���������ģ�����������ı߳����������ζԽ��ߵij��ȼ��㡣
(1)��̬Feԭ�ӵĺ���۵����Ų�ʽΪ[Ar]3d64s2����̬Feԭ�Ӽ۲����Ϊ��3d��4s�ܼ��ϵ��ӣ����̬Feԭ�ӵĺ���۵����Ų�ͼΪ![]() ����̬Sԭ�ӵ���ռ�ݵ��ܼ���1s��2s��2p��3s��3p������ܼ�Ϊ3p�������������ͼΪ�����Σ�
����̬Sԭ�ӵ���ռ�ݵ��ܼ���1s��2s��2p��3s��3p������ܼ�Ϊ3p�������������ͼΪ�����Σ�
(2)H2S��Sԭ�Ӽ۲���ӶԸ���=2+![]() =4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+
=4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+![]() =3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+
=3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3������ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���H2S��
=3������ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���H2S��
(3)S8��SO2�����Ӿ��壬���Ӿ����۷е�������Ӽ������������ȣ����Ӽ�������������Է������������ȣ�S8��Է�����������SO2�����Է��Ӽ�������S8����SO2�������۷е�S8����SO2��
(4)SO3��span>Sԭ�Ӽ۲���ӶԸ���=3+![]() =3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹��Ϊƽ���������Σ��÷�����S-Oԭ��֮�����������������������Թ��ۼ�����2�֣��÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ�����Ϊsp3��
=3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹��Ϊƽ���������Σ��÷�����S-Oԭ��֮�����������������������Թ��ۼ�����2�֣��÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ�����Ϊsp3��
(5)�����߳�Ϊanm=a��10-7cm���������=(a��10-7cm)3���þ�����Fe2+����=1+12��![]() =4��S22-����=8��
=4��S22-����=8��![]() +6��
+6��![]() =4���侧���ܶ�=
=4���侧���ܶ�=![]() =
=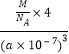 g/cm3=
g/cm3=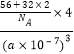 g/cm3��������Fe2+λ��S22-���γɵİ���������ģ������������ƽ��Խ���Ϊ
g/cm3��������Fe2+λ��S22-���γɵİ���������ģ������������ƽ��Խ���Ϊ![]() anm������������ı߳�Ϊ
anm������������ı߳�Ϊ![]() nm��1molFeS2�����к���Fe2+��S22-������Ϊ2NA��
nm��1molFeS2�����к���Fe2+��S22-������Ϊ2NA��

 ������������ϵ�д�
������������ϵ�д�