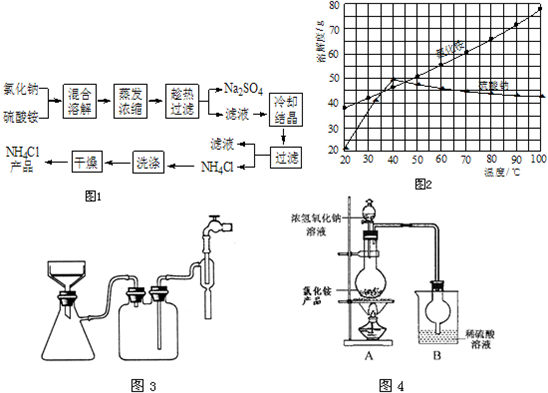
题目内容
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下(如图1):
氯化铵和硫酸钠的溶解度随温度变化如图2所示.回答下列问题:
(1)写出制备 NH4Cl的化学方程式:______.
(2)实验室进行蒸发浓缩用到的主要仪器有______、带铁圈的铁架台、玻璃棒、酒精灯等.
(3)实验过程中趁热过滤的目的是______.冷却结晶后的过滤采用抽滤,其装
置如图3所示,请指出该装置中的错误之处______;
(4)趁热过滤后,滤液冷却结晶.一般情况下,下列哪些因素有利于得到较大的晶体______.
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
(5)为定粗产品的含氮量,称取11.2gNH4Cl粗产品,用图4装置进行实验,充分反应后,测得B装置增重3.4g.则该粗产品中含氮的质量分数为______.
解:(1)由溶解度曲线可知,氯化铵的溶解度受温度影响较大,可利用复分解反应生成氯化铵,冷却结晶法即可,发生的反应为(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4,
故答案为:(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4;
(2)蒸发操作中的仪器有蒸发皿、带铁圈的铁架台、玻璃棒、酒精灯等,故答案为:蒸发皿;
(3)趁热过滤,防止温度降低,氯化铵晶体析出而损失;根据图3可知错误之处为布氏漏斗的颈口斜面未与吸滤瓶的支管口相对,
故答案为:防止温度降低,氯化铵晶体析出而损失;布氏漏斗的颈口斜面未与吸滤瓶的支管口相对;
(4)趁热过滤后,滤液冷却结晶,一般情况下,若得到较多的晶体,应缓慢冷却及蒸发可得到较多的氯化铵,故答案为:AD;
(5)B装置增重3.4g,则n(N)=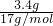 =0.2mol,则11.2gNH4Cl粗产品中N元素的质量分数为
=0.2mol,则11.2gNH4Cl粗产品中N元素的质量分数为 ×100%=25%,故答案为:25%.
×100%=25%,故答案为:25%.
分析:(1)由溶解度曲线可知,氯化铵的溶解度受温度影响较大,可利用复分解反应生成氯化铵,冷却结晶法即可;
(2)蒸发操作必须使用蒸发皿;
(3)趁热过滤,防止氯化铵流失;根据图3分析布氏漏斗的颈口斜面与吸滤瓶的支管口;
(4)缓慢冷却及蒸发可得到较多的氯化铵;
(5)B中增重质量为氨气的质量,由N元素守恒计算.
点评:本题考查氯化铵的制备及混合物的分离,注意氯化铵的溶解度受温度的影响及冷却结晶法是解答本题的关键,题目难度中等.
故答案为:(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4;
(2)蒸发操作中的仪器有蒸发皿、带铁圈的铁架台、玻璃棒、酒精灯等,故答案为:蒸发皿;
(3)趁热过滤,防止温度降低,氯化铵晶体析出而损失;根据图3可知错误之处为布氏漏斗的颈口斜面未与吸滤瓶的支管口相对,
故答案为:防止温度降低,氯化铵晶体析出而损失;布氏漏斗的颈口斜面未与吸滤瓶的支管口相对;
(4)趁热过滤后,滤液冷却结晶,一般情况下,若得到较多的晶体,应缓慢冷却及蒸发可得到较多的氯化铵,故答案为:AD;
(5)B装置增重3.4g,则n(N)=
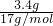 =0.2mol,则11.2gNH4Cl粗产品中N元素的质量分数为
=0.2mol,则11.2gNH4Cl粗产品中N元素的质量分数为 ×100%=25%,故答案为:25%.
×100%=25%,故答案为:25%.分析:(1)由溶解度曲线可知,氯化铵的溶解度受温度影响较大,可利用复分解反应生成氯化铵,冷却结晶法即可;
(2)蒸发操作必须使用蒸发皿;
(3)趁热过滤,防止氯化铵流失;根据图3分析布氏漏斗的颈口斜面与吸滤瓶的支管口;
(4)缓慢冷却及蒸发可得到较多的氯化铵;
(5)B中增重质量为氨气的质量,由N元素守恒计算.
点评:本题考查氯化铵的制备及混合物的分离,注意氯化铵的溶解度受温度的影响及冷却结晶法是解答本题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
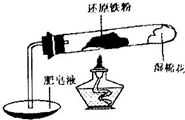 铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.
(1)实验中使用肥皂液的作用是______.
(2)甲同学对实验后试管内的黑色固体X含有哪些物质进行了探究.
提出假设:①所得固体是FeO
②所得固体是Fe3O4
③所得固体是______.
实验探究:
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热. | 黑色粉末逐渐溶解,有少量气泡产生. |
| ② | 取试管1反应后的溶液少许,滴加几滴KSCN溶液,振荡. | 溶液没有出现血红色. |
| ③ | 取试管1反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡 | 高锰酸钾溶液褪色 |
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4.

①溶液X中发生氧化还原反应的离子方程式为______;
②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是______;
③如果取固体样品m1克,反应后得到红棕色固体m2克,则m1与m2之比最少应大于______时,才能确定固体样品中一定存在Fe3O4.
某无色澄清溶液含有以下离子中的若干种:Na+、NH4+、Cu2+、Fe3+、Ca2+、Cl-、SO42-、CO32-,现分别取2份200mL该溶液进行如下实验:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加足量NaOH溶液并加热 | 收集到气体2.24L(已折算成标准状况下的体积) |
| ② | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后过滤、洗涤、干燥、称量 | 第一次称量读数为12.54g,第二次称量读数为4.66g |
试回答下列问题:
(1)该混合物中一定不存在的离子是______.
(2)试写出实验①发生反应的离子方程式______.
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol?L-1) |
| ______ | ______ |
| ______ | ______ |
| ______ | ______ |
(4)判断混合物中是否存在Na+并说明理由?______.
 用下图表示的一些物质或概念间的从属关系中不正确的是
用下图表示的一些物质或概念间的从属关系中不正确的是