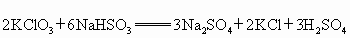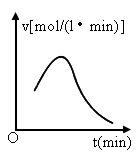题目内容
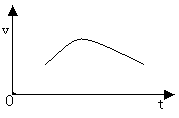
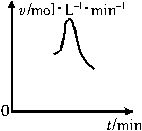
已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速v和反应时间,t的关系如图所示.

已知这个反应的反应速率随溶液中氢离子浓度增大而加快,试解释:
(1)反应开始后,反应速率加快的原因是_______________________.
(2)反应后期,反应速率下降的原因是_________________________.
答案:略
解析:
解析:
|
(1) 该反应的化学方程式是:
开始时,随着反应的进行,不断有强酸  生成, 生成,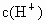 不断增大,反应速率也随之增大. 不断增大,反应速率也随之增大.
(2) 随着时间的延长,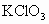 和 和 被消耗而愈来愈少,浓度愈来愈小,因此反应速率下降.其他条件不变时,增大反应物浓度可以加快反应速率,反之,减小反应物浓度则可以减慢反应速率.这里需注意: 被消耗而愈来愈少,浓度愈来愈小,因此反应速率下降.其他条件不变时,增大反应物浓度可以加快反应速率,反之,减小反应物浓度则可以减慢反应速率.这里需注意:
①浓度的一般讨论对象为气体或溶液,对于纯液体或固体一般情况下其浓度是定值. ②若反应为可逆反应,浓度改变的物质既可以是反应物也可以是生成物,甚至可以两者同时改变,此时正逆反应速率均符合“浓快稀慢”的规律. |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目