题目内容
【题目】 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是( )
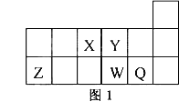
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
【答案】A
【解析】试题分析:根据各元素在元素周期表中的位置可知X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素。A、元素X为N,最高化合价为+5,元素Z为Al,最高化合价为+3,所以最高正化合价之和的数值等于8,正确;B、第三周期元素的原子半径大于第二周期元素的原子半径,同一周期主族元素的原子半径随原子序数的增大而减小,所以原子半径的大小顺序为:rZ>rW>rQ> rX>rY,错误;C、离子Y2-和Z 3+的核外电子数和电子层数都相同,错误;D、元素W的最高价氧化物对应的水化物的酸性比Q的弱,错误。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。

