题目内容
【题目】下列叙述和判断正确的是
A. H3O+离子的空间构型是平面三角形
B. NH![]() 的中心原子的杂化轨道类型是sp3杂化,离子呈三角锥形结构
的中心原子的杂化轨道类型是sp3杂化,离子呈三角锥形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D. C2H4分子中的碳原子以sp2杂化,其中C=C键是由两个碳原子的sp2-sp2轨道形成一个σ键和p-p轨道形成一个π键构成的
【答案】D
【解析】A. H3O+中O原子的孤电子对数为: ![]() =1,价层电子对数为:3+1=4,所以其空间构型是三角锥形,故A错误;NH4+中N原子的孤电子对数为:
=1,价层电子对数为:3+1=4,所以其空间构型是三角锥形,故A错误;NH4+中N原子的孤电子对数为: ![]() =0,价层电子对数为:4+0=4,所以NH4+的中心原子杂化轨道类型为sp3,离子呈正四面体构型,故B错误;C. 甲烷分子中碳原子含有4个σ键且不含孤电子对,所以碳原子以sp3杂化,4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个σ键,故C错误;D. C2H4分子中的碳原子形成3个σ键且无孤电子对,所以碳原子以sp2杂化,其中C=C键是由两个碳原子的sp2-sp2轨道形成一个σ键和未参加杂化的p-p轨道“肩并肩”形成一个π键构成的,故D正确;答案选D。
=0,价层电子对数为:4+0=4,所以NH4+的中心原子杂化轨道类型为sp3,离子呈正四面体构型,故B错误;C. 甲烷分子中碳原子含有4个σ键且不含孤电子对,所以碳原子以sp3杂化,4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个σ键,故C错误;D. C2H4分子中的碳原子形成3个σ键且无孤电子对,所以碳原子以sp2杂化,其中C=C键是由两个碳原子的sp2-sp2轨道形成一个σ键和未参加杂化的p-p轨道“肩并肩”形成一个π键构成的,故D正确;答案选D。

【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。右表是1 L“鲜花保鲜剂”的成分(其中阿司匹林不含K+ ,其存在也不会干扰成分中其他离子的检验),回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是_____________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为________________ mol·L-1。(只要求写表达式,不用化简,不需计算)。
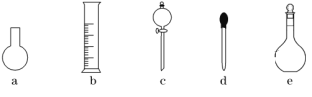
(3)下图所示的仪器中,在配制一定量浓度的“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有_______________(填仪器名称)。
(4)市面上,有一种营养液可用于无土栽培,该营养液中有KCl和K2SO4,其中K+的浓度为0.5mol/L,Cl-的浓度为0.1mol/L,则100mL该营养液中n(SO42-)=_______ mol。
(5)欲检验“鲜花保鲜剂”中的硫酸根离子,步骤是:取少量鲜花保鲜剂于试管中,滴加足量的盐酸后,再滴加___________溶液,看到______________,证明有硫酸根离子。