题目内容
【题目】从铝土矿![]() 主要成分是
主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质
、MgO等杂质![]() 中提取氧化铝的两种工艺流程如下:
中提取氧化铝的两种工艺流程如下:
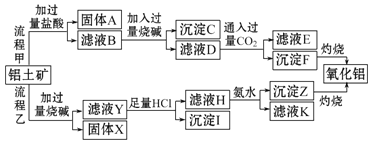
请回答下列问题:
![]() 固体A是______,沉淀F是______,沉淀I是______
固体A是______,沉淀F是______,沉淀I是______![]() 写出有关的化学式
写出有关的化学式![]()
![]() 流程甲中加入过量烧碱得到滤液D的离子方程式为______
流程甲中加入过量烧碱得到滤液D的离子方程式为______
![]() 流程乙加入烧碱有关的化学方程式为______、______
流程乙加入烧碱有关的化学方程式为______、______
![]() 流程乙中滤液H中加入氨水的有关离子方程式______
流程乙中滤液H中加入氨水的有关离子方程式______
![]() 滤液E中溶质的主要成分是___
滤液E中溶质的主要成分是___![]() 填化学式
填化学式![]() ,写出该溶质的一种用途______。
,写出该溶质的一种用途______。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
![]() NaCl、
NaCl、![]() 制纯碱或做发酵粉等
制纯碱或做发酵粉等
【解析】
由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁和盐酸,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠和氢氧化钠,滤液Y中加入足量盐酸,生成沉淀I为硅酸,滤液H为氯化铝和盐酸,滤液H中加入氨水,沉淀Z为Al(OH)3、滤液K中含有氯化铵,据此分析解答。
(1)由以上分析可知固体A为SiO2,沉淀F为Al(OH)3,沉淀I为H2SiO3,故答案为:SiO2;Al(OH)3;H2SiO3;
(2)滤液B中Al3+与过量烧碱反应的离子方程式为Al3++2OH-=AlO2-+H2O,故答案为:Al3++2OH-=AlO2-+H2O;
(3)流程乙加入烧碱,Al2O3、SiO2能和氢氧化钠反应,有关的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O;
(4)流程乙中滤液H中加入氨水的有关离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(5)滤液E中含有NaCl、NaHCO3,碳酸氢钠可用于制纯碱或做发酵粉或做抗酸药等,故答案为:NaCl、NaHCO3;制纯碱或做发酵粉等。

【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。



