题目内容
过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.对于下列A~F涉及H2O2的反应,回答相关问题:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
F.H2O2+Fe2++H+═Fe3++H2O
(1)上述反应不属于氧化还原反应的是(填代号)______.
(2)H2O2仅体现还原性的反应是(填代号)______.
(3)H2O2既体现氧化性又体现还原性的反应是(填代号)______.
(4)H2O2体现酸性的反应是(填代号)______.
(5)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是:______.
(6)通过以上反应分析,H2O2常称为绿色氧化剂,原因是______.
(7)请配平化学反应F,并画出电子转移情况.
______H2O2+______Fe2++______H+═______Fe3++______H2O
(8)由于H2O2有较强氧化性,能使某些有色试剂褪色,具有漂白作用,另外它还有弱酸性,某学生将H2O2溶液滴入含有酚酞的氢氧化钠溶液中,观察到溶液的红色消失.为了探究溶液褪色的原因,该学生提出了两种假设,然后又设计了一个简单的实验方案,以验证这两种假设.请回答:
(A)该学生提出的两种假设是:假设①______;假设②______.
(B)将该学生设计的简单实验方案、预测的实验现象及结论填入下表(结论部分只需填①或②):
| 简单实验方案 | 预测的实验现象 | 结论 |
| ______ | ______ | 假设______成立 |
| ______ | 假设______成立 |
解:(1)反应前后各元素化合价不变的化学反应是非氧化还原反应,A中各元素在反应前后没有化合价的变化,所以是非氧化还原反应,故选A;
(2)B反应中,双氧水中氧元素失电子化合价升高作还原剂,所以体现还原性,故选B;
(3)C反应中,双氧水中的氧元素既有化合价的升高又有化合价的降低,所以既体现氧化性又体现还原性,故选C;
(4)A体现双氧水有酸性,它是二元弱酸,故选A;
(5)反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4,故氧化性顺序为:Ag2O>H2O2>K2CrO4,故答案为:Ag2O>H2O2>K2CrO4;
(6)双氧水的还原产物为水,对环境无污染,所以是绿色氧化剂,故答案为:还原产物通常为水,对环境无污染;
(7)一个双氧水分子参加氧化还原反应时得2个电子,一个亚铁离子参加氧化还原反应失去一个电子,所以得失电子的最小公倍数是2,则双氧水的计量数是1,亚铁离子的计量数是2,然后根据原子守恒配平其它原子,所以该反应是
 ,
,
故答案为: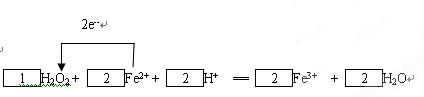 ;
;
(8)(A)通过题意知,双氧水有强氧化性和酸性,所以提出的两种假设为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化,
故答案为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况,如果溶液又变红色,则假设①成立;如果溶液颜色无变化,则假设②成立,
故答案为:
分析:(1)反应前后各元素化合价不变的化学反应是非氧化还原反应;
(2)反应前后双氧水中的元素失电子化合价升高,则双氧水体现还原性;
(3)反应前后双氧水中的元素既得电子又失电子,则双氧水体现氧化性和还原性;
(4)H2O2又名过氧乙酸,有酸性,它是二元弱酸;
(5)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性;
(6)双氧水的还原产物为水,是绿色氧化剂;
(7)根据氧化还原反应中得失电子数相等配平方程式;
(8)(A)能使酚酞褪色的原因有两个:一个是体现双氧水的强氧化性,一个是体现双氧水的酸性;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况.
点评:本题考查了氧化还原反应的有关知识,根据反应前后元素化合价的变化判断其氧化性、还原性即可,难度不大.
(2)B反应中,双氧水中氧元素失电子化合价升高作还原剂,所以体现还原性,故选B;
(3)C反应中,双氧水中的氧元素既有化合价的升高又有化合价的降低,所以既体现氧化性又体现还原性,故选C;
(4)A体现双氧水有酸性,它是二元弱酸,故选A;
(5)反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4,故氧化性顺序为:Ag2O>H2O2>K2CrO4,故答案为:Ag2O>H2O2>K2CrO4;
(6)双氧水的还原产物为水,对环境无污染,所以是绿色氧化剂,故答案为:还原产物通常为水,对环境无污染;
(7)一个双氧水分子参加氧化还原反应时得2个电子,一个亚铁离子参加氧化还原反应失去一个电子,所以得失电子的最小公倍数是2,则双氧水的计量数是1,亚铁离子的计量数是2,然后根据原子守恒配平其它原子,所以该反应是
 ,
,故答案为:
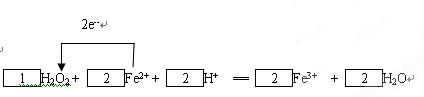 ;
;(8)(A)通过题意知,双氧水有强氧化性和酸性,所以提出的两种假设为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化,
故答案为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况,如果溶液又变红色,则假设①成立;如果溶液颜色无变化,则假设②成立,
故答案为:
| 简单实验方案 | 预测的实验现象 | 结论 |
| 向褪色后的溶液中再加入过量NaOH溶液 | 溶液又变红色 | ① |
| 溶液颜色无变化(依然为无色) | ② |
分析:(1)反应前后各元素化合价不变的化学反应是非氧化还原反应;
(2)反应前后双氧水中的元素失电子化合价升高,则双氧水体现还原性;
(3)反应前后双氧水中的元素既得电子又失电子,则双氧水体现氧化性和还原性;
(4)H2O2又名过氧乙酸,有酸性,它是二元弱酸;
(5)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性;
(6)双氧水的还原产物为水,是绿色氧化剂;
(7)根据氧化还原反应中得失电子数相等配平方程式;
(8)(A)能使酚酞褪色的原因有两个:一个是体现双氧水的强氧化性,一个是体现双氧水的酸性;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况.
点评:本题考查了氧化还原反应的有关知识,根据反应前后元素化合价的变化判断其氧化性、还原性即可,难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目