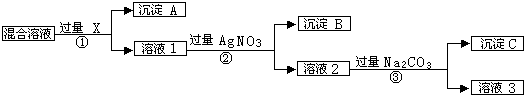
题目内容
1.NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1molH2中含有的氢原子数为2NA | |
| B. | 22.4L氧气所含的氧原子数为2NA | |
| C. | 常温常压下,28g氮气所含的分子数为2NA | |
| D. | 2g氢气所含的氢原子数为NA |
分析 A、氢气是双原子分子;
B、氧气所处的状态不明确;
C、求出氮气的物质的量,然后根据分子个数N=nNA来计算;
D、求出氢气的物质的量,然后根据氢气是双原子分子来计算.
解答 解:A、氢气是双原子分子,故1mol氢气中含2mol氢原子,即2NA个,故A正确;
B、氧气所处的状态不明确,不一定是标况,故其物质的量不一定是1mol,含有的氧原子的个数不一定是2NA,故B错误;
C、28g氮气的物质的量为1mol,故含有的分子个数N=nNA=NA,故C错误;
D、2g氢气的物质的量为1mol,而氢气是双原子分子,故1mol氢气中含2mol氢原子,即2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列有关化学用语正确的是( )
| A. | CO2的电子式  | |
| B. | Cl-的结构示意图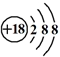 | |
| C. | 8个中子的碳原子的核素符号:${\;}_{6}^{14}$C | |
| D. | HF的电子式: |
12.在平衡体系Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使c(OH-)增大的是( )
| A. | 加入少量MgCl2固体 | B. | 继续加水 | ||
| C. | 加入少量Na2CO3固体 | D. | 升高温度 |
9.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 硫酸与氢氧化钡发生中和反应的热化学方程式为:H+(aq)+SO42-(aq)+Ba2+(aq)+OH-(aq)=BaSO4(s)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+ |
16.4.48L一定条件下的氯化氢气体通入水中得到0.1L盐酸,此溶液中c(Cl-)=2mol/L,则“一定条件”可能是( )
| A. | 25℃ | B. | 1.01×103Pa | C. | 101kPa | D. | 0℃ |
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,5.6L CCl4含有的分子数为0.25 NA | |
| C. | 在标准状况下,2.8g N2和2.24LCO所含质子数均为1.4NA | |
| D. | 常温下,1 L pH=1的硫酸溶液中含有的H+数为0.05NA |
10.从2mol/L的氯化铜溶液中取出含Cl-为0.5mol的溶液,所取溶液的体积是( )
| A. | 1 L | B. | 0.5 L | C. | 0.25 L | D. | 0.125L |
16.下列说法中不正确的是( )
| A. | 对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值最小 | |
| B. | 强电解质的水溶液导电能力不一定比弱电解质水溶液的导电能力强 | |
| C. | pH=5的溶液和pH=3的溶液相比,前者c(H+)是后者的100倍 | |
| D. | 在25℃,101KPa时,1mol碳完全燃烧生成二氧化碳气体时放出的热量为碳的燃烧热 |