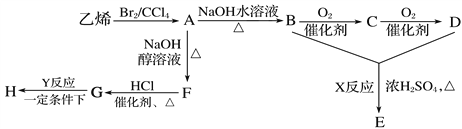
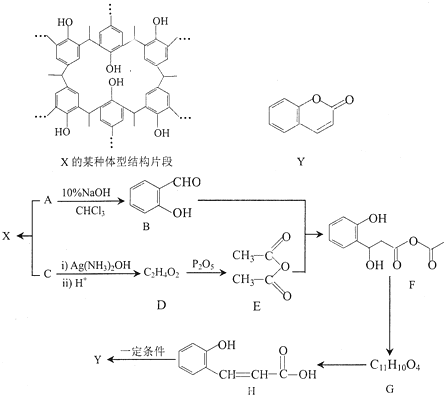
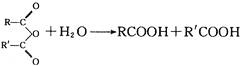
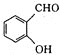
题目内容
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是( )
A. 甲醇低温所制氢气用于新能源汽车
甲醇低温所制氢气用于新能源汽车
B. 氘、氘用作“人造太阳”核聚变燃料
氘、氘用作“人造太阳”核聚变燃料
C. 偏二甲肼用作发射“天宫二号”的火箭燃料
偏二甲肼用作发射“天宫二号”的火箭燃料
D.![]() 开采可燃冰,将其作为能源使用
开采可燃冰,将其作为能源使用
【答案】B
【解析】
A.由甲醇制备氢气的过程中有新物质生成,显然属于化学变化,A错误;
B.原子是化学变化中的最小粒子,核聚变过程中原子发生了变化,但是没有新物质生成,所以核聚变不是化学反应,B正确;
C.偏二甲肼用作发射火箭的燃料,是利用其还原性,与氧化剂(常见的是四氧化二氮)发生氧化还原反应,反应时放出大量的热把火箭送入太空,C错误;
D.可燃冰作为能源是由于其主要成分(甲烷)燃烧时放出大量的热,燃烧属于化学变化,D错误。
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,

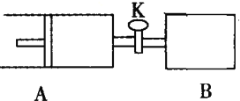
现用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是__________。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 __________________。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是_______________。
(3)在装置C中应加入NaOH溶液,其目的是____________。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法 ______________。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置分层、分液后,若产物中有少量未反应的Br2,最好用______________洗涤除去;若产物中有少量副产物乙醚,可用________(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是________________。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为__________________。
【题目】有机物A 可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A 为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A9.0g,升温其汽化,测其密度是相同条件下H2的45 倍. | 试通过计算填空: |
(2)将9.0gA在足量纯O2中充分燃烧,并使一其产物依次缓缓通过浓硫酸、碱石灰.发现两者分别增重5.4g和13.2g | (2)A的分子式为__________。 |
(3)另取A9.0g,跟足量的NaCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)写出A中所含官能团的名称______。 |
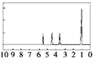
( 4 ) A 的核磁共振氢谱如下图: | ( 4 ) A中含有______种氢原子 |
(5)综上所述,A的结构简式为___________ | |