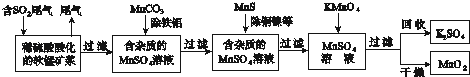
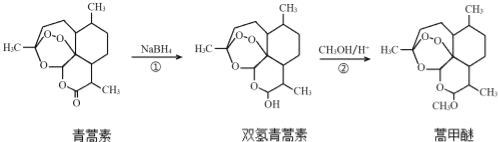
��Ŀ����
����Ŀ����ѧ��һ����ʵ��Ϊ�������о����ʵ���ɡ��ṹ�����ʼ���仯���ɵ���Ȼ��ѧ��ѧϰ��ѧ�о��Ļ������������Լ���Կ�ѧ���ʵ���ʶ�������������������ʶ�������й���������ȷ����
A. �òⶨ�ӽ�ˮ�ķе��ˮ������Է��������ķ�����֪ˮ���Ӽ�����γ����
B. ��Է��������IJⶨ���������ǣ����������ڣ��л�����������ڸ���ջ����±����ܵ������������Ҫ�γɴ��������Ƭ
C. ���ú�����ס��˴Ź��������ִ�����������ѧ�������ɲⶨC2H6O�ķ��ӽṹ
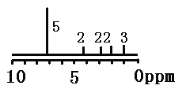
D. ij�л������ʽΪC11H14O2����H��NMRͼ������ͼ(���Ҳ����������ֱ�ʾH�ĸ�������֪��7.2ppm(5H)Ϊ����)�����Ʋ���л������Ϊ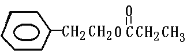
���𰸡�B
��������A���òⶨ�ӽ�ˮ�ķе��ˮ������Է��������ķ�����֪ˮ���Ӽ�����γ������A��ȷ��
B����Է��������IJⶨ���������ǣ����������ڣ��л�����������ڸ���ջ����±����ܵ������������Ҫ�γɴ��������Ƭ��B����C���������ڲⶨ��Է�������������������ڲⶨ���ӽṹ��C��ȷ��D���л���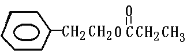 �У������������4�ֲ�ͬ��ѧ��������ԭ�ӣ�������4�ֻ����е���ԭ�Ӹ�����Ϊ1��2��2��2��2��2��3��D����ѡB��
�У������������4�ֲ�ͬ��ѧ��������ԭ�ӣ�������4�ֻ����е���ԭ�Ӹ�����Ϊ1��2��2��2��2��2��3��D����ѡB��

����Ŀ��X��Y��Z��W��Q��R��Ϊǰ������Ԫ�أ���ԭ���������������������Ϣ���±���ʾ��
XԪ�صĻ�̬ԭ���е��ӷֲ���������ͬ���ܼ��У���ÿ���ܼ��еĵ���������ͬ |
YԪ�ص���̬�⻯����������������Ӧ��ˮ�����ܷ������Ϸ�Ӧ |
ZԪ�ص����������������������� |
Wԭ�ӵĵ�һ�����������ֱܷ�Ϊ��I1=578KJmol��1 I2=1817KJmol��1 I3=2745KJmol��1I4=11575KJmol��1 I5=14830KJmol��1 I6=18376KJmol��1 |
QΪǰ�������е縺����С��Ԫ�� |
Ԫ��Rλ�����ڱ��ĵ�10�� |
�ش��������⣺
��1��YԪ�صĻ�̬ԭ����δ�ɶԵ�����Ϊ��X��Y��Z����Ԫ��ԭ�ӵĵ�һ��������С�����˳��Ϊ����Ԫ�ط��ű�ʾ����
��2��W���Ȼ�����۵��Q���Ȼ�����۵�����ߡ��͡�����������
��3������֤ʵԪ��W�ĵ�����ǿ������Һ��Ӧ��[W��OH��4]�����ɣ���[W��OH��4]���д��ڣ�����ĸ�� �� a�����Թ��ۼ� b���Ǽ��Թ��ۼ� c����λ�� d�����
��4������X��R��þ����Ԫ�ص�ij�־�����г����ԣ���ṹ��ͼ��ʾ����þ���Ļ�ѧʽΪ��������ÿ��þԭ����Χ���������Rԭ��������