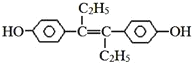
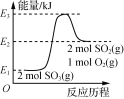
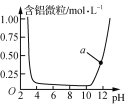
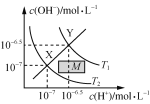
题目内容
【题目】汽车用汽油的抗爆剂约含 17%的 1,2一二溴乙烷。某学习小组用下图所示装置制备少量 1,2 一二溴乙烷,具体流秳如下: 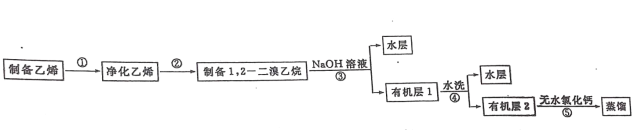
已知:1,2 一二溴乙烷的沸点为131℃,熔点为9.3℃。Ⅰ1,2 一二溴乙烷的制备步聚①、②的实验装置为:

实验步骤:
(ⅰ)在冰水冷却下,将 24mL 浓硫酸慢慢注入12mL乙醇中混合均匀。
(ⅱ)向 D 装置的试管中加入3.0mL 液溴(0.10mol),然后加入适量水液封,幵向烧杯中加入冷却剂。
(ⅲ)连接仪器并检验气密性。向三口烧瓶中加入碎瓷片,通过滴液漏斗滴入一部分浓硫酸与乙醇的混合物,一部分留在滴液漏斗中。
(ⅳ)先切断瓶C与瓶D的连接处,加热三口瓶,待温度上升到约120℃,连接瓶 C与瓶D,待温度升高到180~200℃,通过滴液漏斗慢慢滴入混合液。
(V)继续加热三口烧瓶,待D装置中试管内的颜色完全褪去,切断瓶C与瓶D的连接处,再停止加热。回答下列问题:
(1)图中 B 装置玻璃管的作用为__________________________________________。
(2)(ⅳ)中“先切断瓶C与瓶D的连接处,再加热三口瓶”的原因是__________________________________________。
(3)装置D的烧杯中需加入冷却剂,下列冷却剂合适的为__________________________________________。
a.冰水混合物 b.5℃的水 c.10℃的水
Ⅱ1,2 一二溴乙烷的纯化
步骤③:冷却后,把装置 D 试管中的产物转移至分液漏斗中,用 1%的氢氧化钠水溶液洗涤。
步骤④:用水洗至中性。
步骤⑤:“向所得的有机层中加入适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集
130~132℃的馏分,得到产品5.64g。
(4)步骤③中加入 1%的氢氧化钠水溶液时,发生反应的离子方程式为__________________________________________。
(5)步骤⑤中加入无水氯化钙的作用为_________________________。该实验所得产品的产率为__________________________________________。
【答案】指示 B 中压强变化,避免气流过快引起压强过大 防止乙烯生成前装置中的热气体将溴吹出而降低产率 c Br2+2OH-=Br-+BrO-+H2O 干燥产品(除去产品中的水) 30%
【解析】
(1)图中B装置气体经过,但B中气体流速过快,则压强会过大,通过观察B中玻璃管可以看出气体的流速和反应速率,因此玻璃管的作用为指示B中压强变化,避免气流过快引起压强过大。
(2)(ⅳ)中“先切断瓶C与瓶D的连接处,再加热三口瓶”的原因是防止乙烯生成前装置中的热气体将溴吹出而降低产率。
(3)装置D的烧杯中需加入冷却剂,因为1,2一二溴乙烷的沸点为131℃,熔点为9.3℃,因此只能让1,2一二溴乙烷变为液体,不能变为固体,变为固体易堵塞导气管,因此合适冷却剂为c。
(4)步骤③中加入1%的氢氧化钠水溶液主要是将1,2一二溴乙烷中的单质溴除掉,发生反应的离子方程式为Br2+2OH-=Br-+BrO-+H2O。
(5)步骤⑤中加入无水氯化钙的作用为干燥产品(除去产品中的水);单质溴为0.1mol,根据质量守恒得到1,2一二溴乙烷理论物质的量为0.1mol,因此该实验所得产品的产率为![]() 。
。
(1)图中B装置气体经过,但B中气体流速过快,则压强会过大,通过观察B中玻璃管可以看出气体的流速和反应速率,因此玻璃管的作用为指示B中压强变化,避免气流过快引起压强过大,故答案为:指示B中压强变化,避免气流过快引起压强过大。
(2)(ⅳ)中“先切断瓶C与瓶D的连接处,再加热三口瓶”的原因是防止乙烯生成前装置中的热气体将溴吹出而降低产率,故答案为:防止乙烯生成前装置中的热气体将溴吹出而降低产率。
(3)装置D的烧杯中需加入冷却剂,因为1,2一二溴乙烷的沸点为131℃,熔点为9.3℃,因此只能让1,2一二溴乙烷变为液体,不能变为固体,变为固体易堵塞导气管,因此合适冷却剂为c,故答案为:c。
(4)步骤③中加入1%的氢氧化钠水溶液主要是将1,2一二溴乙烷中的单质溴除掉,发生反应的离子方程式为Br2+2OH-=Br-+BrO-+H2O,故答案为:Br2+2OH-=Br-+BrO-+H2O。
(5)步骤⑤中加入无水氯化钙的作用为干燥产品(除去产品中的水);单质溴为0.1mol,根据质量守恒得到1,2一二溴乙烷理论物质的量为0.1mol,因此该实验所得产品的产率为![]() ,故答案为:干燥产品(除去产品中的水);30%。
,故答案为:干燥产品(除去产品中的水);30%。

【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用溢流法连续制备无水四氯化锡,实验装置图如图:
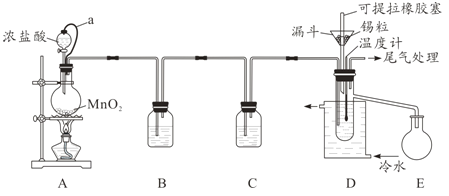
查阅资料可知:
①Sn(s)+2Cl2(g)=SnCl4(l) ΔH=-511kJ/mol
②SnCl4易挥发,极易发生水解。
③相关物质的物理性质如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
密度/g·cm-3 | 7.310 | 2.226 | 3.386 |
回答下列问题:
(1)a管的作用是__________。
(2)A中反应的离子方程式是__________。
(3)D中冷却水的作用是________________。
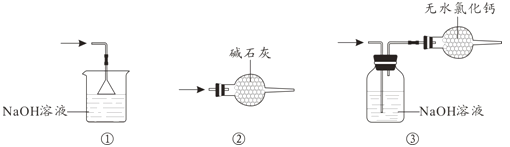
(4)尾气处理时,可选用的装置是__________(填序号)。
(5)锡粒中含铜杂质致D中产生CuCl2,但不影响E中产品的纯度,原因是________。
(6)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3=SnCl4+2FeCl2,再用0.1000mol/LK2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液20.00mL,则SnCl4产品的纯度为__________。
【题目】我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) | |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | Ⅰ.CH4(g)+H2O(g) | +206.2 | 240.1 |
Ⅱ.CH4(g)+2H2O(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用