题目内容
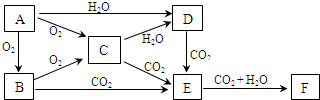
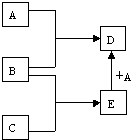
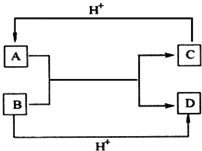
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,K与L含有完全相同的元素.
②D、J为固体单质,R为气体单质,其余物质为常见化合物.
③A能使品红溶液褪色,也能使澄清石灰水变浑浊.
④E为淡黄色化合物,E与C或L反应都能生成R.
⑤I为氧化物,I与F或C都能反应;G和L反应生成难溶物H,H具有较强的吸附性.
根据以上信息,回答下列问题:
(1)写出下列反应的化学方程式:
①C→A:______
②L→R:______.
(2)写出下列反应的离子方程式:①E→F:______②I→G:______.
(3)常温下,测得一定浓度G溶液的pH=10,试用离子方程式表示其原因:______.

已知:①图中每个小三角形的三种物质中至少含有一种相同元素,K与L含有完全相同的元素.
②D、J为固体单质,R为气体单质,其余物质为常见化合物.
③A能使品红溶液褪色,也能使澄清石灰水变浑浊.
④E为淡黄色化合物,E与C或L反应都能生成R.
⑤I为氧化物,I与F或C都能反应;G和L反应生成难溶物H,H具有较强的吸附性.
根据以上信息,回答下列问题:
(1)写出下列反应的化学方程式:
①C→A:______
②L→R:______.
(2)写出下列反应的离子方程式:①E→F:______②I→G:______.
(3)常温下,测得一定浓度G溶液的pH=10,试用离子方程式表示其原因:______.

A能使品红溶液褪色,也能使澄清石灰水变浑浊,可推出A必为SO2;根据E为淡黄色化合物,E与C或L反应都能生成R.则可推出E必为Na2O2,而R必为O2,而C或L必分别为水、酸和二氧化碳中的一种;再结合J为固体单质、K与L含有完全相同的元素,则可推出K、J、L分别为CO、C和CO2;同时结合D为固体单质,则可推出D必为Na,而F则可能为氧化钠或氢氧化钠,结合I为氧化物,I与F或C都能反应,则最终确定I为两性氧化物Al2O3,而F为NaOH,G为NaAlO2,而G和L(二氧化碳)反应生成难溶物H,H具有较强的吸附性,则H为Al(OH)3;A、B、C分别为二氧化硫、亚硫酸和硫酸,
(1)①C→A的反应为Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O或Na2SO3+H2SO4=Na2SO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O或Na2SO3+H2SO4=Na2SO4+SO2↑+2H2O;
②L→R的反应为2Na2O2+2CO2=2Na2CO3+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2↑;
(2)①E→F的离子反应为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
②I→G的离子反应为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)G为NaAlO2,常温下,测得一定浓度G溶液的pH=10,发生水解使溶液显碱性,水解离子反应为AlO2-+2H2O Al(OH)3+OH-,
Al(OH)3+OH-,
故答案为:AlO2-+2H2O Al(OH)3+OH-.
Al(OH)3+OH-.
(1)①C→A的反应为Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O或Na2SO3+H2SO4=Na2SO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O或Na2SO3+H2SO4=Na2SO4+SO2↑+2H2O;
②L→R的反应为2Na2O2+2CO2=2Na2CO3+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2↑;
(2)①E→F的离子反应为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
②I→G的离子反应为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)G为NaAlO2,常温下,测得一定浓度G溶液的pH=10,发生水解使溶液显碱性,水解离子反应为AlO2-+2H2O
 Al(OH)3+OH-,
Al(OH)3+OH-,故答案为:AlO2-+2H2O
 Al(OH)3+OH-.
Al(OH)3+OH-.
练习册系列答案
相关题目