题目内容
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________________。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
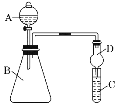
(3)仪器B的名称为____________,干燥管D的作用是防止_____________________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象___________,即可证明。请写出一种制取氯气的化学反应方程式:_______________________________________,从环境保护的角度考虑,此装置缺少尾气处理装置,可用___________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有__________溶液的洗气瓶。
【答案】钾 铝 S2-+Cl2=S↓+2Cl- 锥形瓶 倒吸 变蓝色 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O NaOH 有白色沉淀生成 饱和NaHCO3
MnCl2+Cl2↑+2H2O NaOH 有白色沉淀生成 饱和NaHCO3
【解析】
根据元素周期律结合实验装置分析解答;书写相关反应化学方程式及离子方程式。
Ⅰ.(1)金属性越强越容易与酸反应置换出氢气,反应越剧烈,所以钾反应最剧烈;反应属于氧化还原反应,根据电子得失守恒分析,产生氢气的多少和金属得失电子数目有关,1molAl反应后失电子数目最多,所以铝与盐酸反应产生的气体最多,故答案为:钾;铝;
(2)向Na2S溶液中通入氯气,反应生成单质硫,说明氯气的氧化性强于硫,则Cl的非金属性比S强,反应的离子方程式为 S2-+Cl2=S↓+2Cl-;
Ⅱ.(3)如图所示,仪器B的名称为锥形瓶;根据实验原理及装置特点分析干燥管D的作用是防止倒吸;
(4)要证明非金属性:Cl>I,可以通过氯气置换出碘化钾中的碘来证明,B中生成的氯气通入C中的淀粉碘化钾,若观察到C中溶液变蓝,说明此时有单质碘生成;浓盐酸被氧化生成氯气的方程式为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O;氯气有毒,所以需要尾气处理,氯气与氢氧化钠溶液反应,所以可以用氢氧化钠溶液吸收尾气;
MnCl2+Cl2↑+2H2O;氯气有毒,所以需要尾气处理,氯气与氢氧化钠溶液反应,所以可以用氢氧化钠溶液吸收尾气;
(5)B装置中反应生成二氧化碳气体,二氧化碳通入C中硅酸钠溶液,若溶液有白色沉淀现象,说明生成难溶的硅酸,则碳酸的酸性强于硅酸,非金属性:C>Si;为了防止干扰,要除去二氧化碳气体中的HCl气体,可以用饱和碳酸氢钠溶液洗气。