题目内容
A、B、W、D、E为原子序数依次增大的五种短周期元素,已知:五种元素的原子质子数之和为39,且B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期数与主族序数相等.
(1)E元素在周期表中的位置为
(2)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱.请写出:A2W2的电子式
 ;其第一步电离的电离方程式
;其第一步电离的电离方程式
(3)由A、B两种元素形成的共价化合物甲,摩尔质量为30g/mol,在25℃,101kPa下,5克的甲气体完全燃烧,生成二氧化碳和液态水时放热 a kJ,则可表示甲的燃烧热的热化学方程式为:
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使其转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡印刷电路板达到上述目的,又保护了环境,试写出反应的离子方程式
(1)E元素在周期表中的位置为
三
三
周期ⅢA
ⅢA
族.(2)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱.请写出:A2W2的电子式


H2O2 HO2-+H+
HO2-+H+
 HO2-+H+
HO2-+H+H2O2 HO2-+H+
HO2-+H+
.工业上常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 HO2-+H+
HO2-+H+BaO2+H2SO4=BaSO4↓+H2O2
BaO2+H2SO4=BaSO4↓+H2O2
.(3)由A、B两种元素形成的共价化合物甲,摩尔质量为30g/mol,在25℃,101kPa下,5克的甲气体完全燃烧,生成二氧化碳和液态水时放热 a kJ,则可表示甲的燃烧热的热化学方程式为:
C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l);△H=-6akJ?mol-1
C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l);△H=-6akJ?mol-1
.(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使其转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡印刷电路板达到上述目的,又保护了环境,试写出反应的离子方程式
Cu+2H++H2O2=Cu2++2H2O
Cu+2H++H2O2=Cu2++2H2O
.分析:A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,结合原子结构以及元素对应的单质、化合物的性质可解答该题.
解答:解:A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,则:
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族.
故答案为:三,ⅢA.
(2)A2W2为H2O2,氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对,电子式为 ,H2O2是二元弱酸,以第一步电离为主,则电离方程式为H2O2
,H2O2是二元弱酸,以第一步电离为主,则电离方程式为H2O2 HO2-+H+,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2.
HO2-+H+,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2.
故答案为: ;H2O2
;H2O2 HO2-+H+;BaO2+H2SO4=BaSO4↓+H2O2.
HO2-+H+;BaO2+H2SO4=BaSO4↓+H2O2.
(3)由A、B两种元素形成的共价化合物甲,摩尔质量为30g/mol,则甲为C2H6,5克的乙烷气体的物质的量为
=
mol,1mol乙烷完全燃烧放出的热量为6akJ,在25℃,101kPa下,甲的燃烧热的热化学方程式为:C2H6 (g)+
2O2(g)=2CO2(g)+3H2O(l);△H=-6a kJ?mol-1.
故答案为:C2H6 (g)+
O2(g)=2CO2(g)+3H2O(l);△H=-6a kJ?mol-1.
完全燃烧,生成二氧化碳和液态水时放热 a kJ,
(4)Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O.
故答案为:Cu+2H++H2O2=Cu2++2H2O.
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族.
故答案为:三,ⅢA.
(2)A2W2为H2O2,氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对,电子式为
 ,H2O2是二元弱酸,以第一步电离为主,则电离方程式为H2O2
,H2O2是二元弱酸,以第一步电离为主,则电离方程式为H2O2 HO2-+H+,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2.
HO2-+H+,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2.故答案为:
 ;H2O2
;H2O2 HO2-+H+;BaO2+H2SO4=BaSO4↓+H2O2.
HO2-+H+;BaO2+H2SO4=BaSO4↓+H2O2.(3)由A、B两种元素形成的共价化合物甲,摩尔质量为30g/mol,则甲为C2H6,5克的乙烷气体的物质的量为
| 5g |
| 30g/mol |
| 1 |
| 6 |
| 7 |
| 2 |
故答案为:C2H6 (g)+
| 7 |
| 2 |
完全燃烧,生成二氧化碳和液态水时放热 a kJ,
(4)Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O.
故答案为:Cu+2H++H2O2=Cu2++2H2O.
点评:本题考查元素周期表和元素周期律、无机物的推断、常用化学用语、热化学方程式等,难度中等,本题侧重常见化合物的存在为突破口,注重元素化合物的考查,做题时注意把握题给信息.需要学生具备扎实的基础和综合运用知识解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
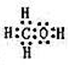
 H++HO2-
H++HO2-