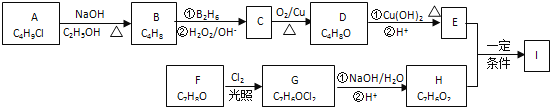
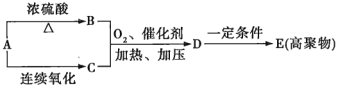
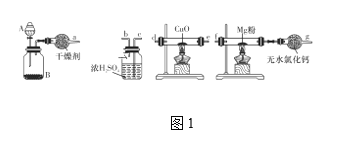
题目内容
【题目】已知下列微粒:①CH4 ②CH2=CH2③CH≡ CH④NH3 ⑤NH4+ ⑥BF3 ⑦H2O ⑧H2O2。试回答下列问题。
(1)分子空间构型为正四面体形的是__________(填序号,下同)。
(2)中心原子为sp3杂化的是__________,中心原子为sp2杂化的是__________,中心原子为sp1杂化的是__________。
(3)所有原子共平面(含共直线)的是__________,共直线的是__________。
【答案】①⑤ ①④⑤⑦⑧ ②⑥ ③ ②③⑥⑦ ③
【解析】
①CH4中C原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以C原子采取sp3杂化,CH4的空间构型为正四面体形;
,所以C原子采取sp3杂化,CH4的空间构型为正四面体形;
②CH2=CH2中C原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以C原子采取sp2杂化,CH2=CH2中所有原子共平面;
,所以C原子采取sp2杂化,CH2=CH2中所有原子共平面;
③CH≡CH中C原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以C原子采取sp1杂化,CH≡CH的空间构型为直线形;
,所以C原子采取sp1杂化,CH≡CH的空间构型为直线形;
④NH3中![]() 原子杂化轨道数
原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以N原子采取sp3杂化,NH3的空间构型为三角锥形;
,所以N原子采取sp3杂化,NH3的空间构型为三角锥形;
⑤NH4+中N原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以N原子采取sp3杂化,NH4+的空间构型为正四面体形;
,所以N原子采取sp3杂化,NH4+的空间构型为正四面体形;
⑥BF3中B原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以B原子采取sp2杂化,BF3的空间构型为平面三角形;
,所以B原子采取sp2杂化,BF3的空间构型为平面三角形;
⑦H2O中O原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以O原子采取sp3杂化,H2O的空间构型为V形;
,所以O原子采取sp3杂化,H2O的空间构型为V形;
⑧H2O2中O原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以O原子采取sp3杂化,H2O2中两个原子犹如在半展开的书的两面纸上并有一定夹角,两个O原子在书的夹缝上。
,所以O原子采取sp3杂化,H2O2中两个原子犹如在半展开的书的两面纸上并有一定夹角,两个O原子在书的夹缝上。
(1)分子空间构型为正四面体形的是①⑤(填序号,下同)。
故答案为:①⑤;
(2)中心原子为![]() 杂化的是①④⑤⑦⑧,中心原子为
杂化的是①④⑤⑦⑧,中心原子为![]() 杂化的是②⑥,中心原子为sp1杂化的是③。
杂化的是②⑥,中心原子为sp1杂化的是③。
故答案为:①④⑤⑦⑧;②⑥; ③ ;
(3)所有原子共平面(含共直线)的是②③⑥⑦,共直线的是③。
故答案为: ②③⑥⑦;③。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
元素 | A | B | C | D |
性质或结构信息 | 单质制成的高压灯发出的黄光透雾力强、射程远 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 | 单质在常温、常压下是气体,原子的 | 2价阳离子的核外电子排布与氖原子相同 |
(1)A与Cl形成的化合物为__________(填“离子”或“共价”)化合物,含有__________键。
(2)D和C形成的化合物中含有__________键。写出C单质与水反应的化学方程式:____________________。
(3)下列对元素B及元素B的常见单质描述正确的是__________(填序号)。
a.B元素的最高正价为+6
b.常温、常压下B的常见单质难溶于水
c.B的常见单质分子中含有18个电子
d.在一定条件下镁条能与B的常见单质反应
(4)若B与H能形成![]() ,则B为__________元素,
,则B为__________元素,![]() 中含有的化学键为__________。
中含有的化学键为__________。
(5)A和D两元素中金属性较强的是__________(写元素符号),写出能证明该结论的一个实验事实:____________________。