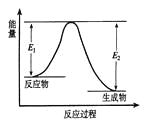
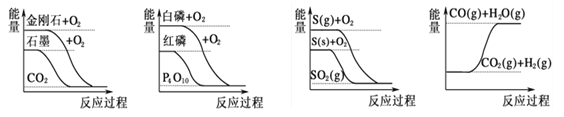
题目内容
【题目】X(g)+2Y(s) ![]() 2Z(g) △H=-akJ/mol,一定条件下,将1molX和2molY加入2L的恒容密闭容器中,10min后测得Y的物质的量为1.4mol。下列说法正确的是
2Z(g) △H=-akJ/mol,一定条件下,将1molX和2molY加入2L的恒容密闭容器中,10min后测得Y的物质的量为1.4mol。下列说法正确的是
A. 10min内,X的平均反应速率为0.03mol/(L·min)
B. 若容器中的气体密度不再发生变化,说明上述反应已达平衡状态
C. 10min后Z的浓度为0.7mol/L
D. 10min内,反应放出的热量为0.3kJ
【答案】B
【解析】根据三段式解答: X(g)+2Y(s) ![]() 2Z(g) △H=-a kJ/mol
2Z(g) △H=-a kJ/mol
起始物质的量(mol) 1 2 0
变化物质的量(mol) 0.3 0.6 0.6
10min后物质的量(mol)0.7 1.4 0.6
10min内,X的平均反应速率为0.3mol÷(2L×10min)=0.015mol/(L·min),A项错误;该反应有固体参加,随着反应的进行气体的质量不断变化,恒容密闭容器体积不变,根据密度=m÷V,当容器中的气体密度不再发生变化时,该反应达到平衡状态,B项正确;C.10min后Z的浓度为0.6mol÷2L=0.3mol/L,C项错误;D.根据题给热化学方程式,10min内,反应放出的热量为
0.3a kJ,D项错误。答案选B。

【题目】实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
应量取盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
_______ | _______ | ______________ |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________;
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是________________________,溶液注入容量瓶前需恢复到室温,这是因为_________________________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度线_______________;若定容时俯视刻度线___________________;未冷却就移液__________ 。