题目内容
4.原子序数依次增大的X、Y、Z、W是周期表中前30号元素,X、Y同周期,已知X的 最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁; Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能级层为全充满 状态,且核外的未成对电子只有一个.请回答下列问题:(1)从电负性角度分析,X、Y、Z三种元素的非金属性由强到弱的顺序为O>C>Si(填元素符号)
(2)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为 第二电离能I2,依次还有I3,I4,I5,推测Z元素的电离能突增最早应出现在第五电离能.
(3)X的某类氢化物中X原子的杂化方式为SP2,则相对分子质量最小的该类氢化物中X原子间存在cd a.离子键 b.配位键 c.δ键 d.π键
(4)W的价电子排布图为
 ;W单质晶体中微粒堆积方式为面心立方堆积,若W单质晶体中一个晶胞的边长为a cm,则W单质晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g/cm3(写出含a的表 达式,用NA表示阿伏加德罗常数的值)g.cm-3.
;W单质晶体中微粒堆积方式为面心立方堆积,若W单质晶体中一个晶胞的边长为a cm,则W单质晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g/cm3(写出含a的表 达式,用NA表示阿伏加德罗常数的值)g.cm-3.
分析 X的最外层电子数是其内层电子数的2倍,则X为碳元素,X与Y形成的常见化合物之一常被用于高炉炼铁,且X、Y同周期,所以Y为氧元素,Z与X同主族,其单质在同周期元素中形成的单质中熔点最高,则Z为硅元素,W原子M能层为全充满状态,且核外的未成对电子只有一个,原子序数小于30,所以W为铜元素,据此答题.
解答 解:X的最外层电子数是其内层电子数的2倍,则X为碳元素,X与Y形成的常见化合物之一常被用于高炉炼铁,且X、Y同周期,所以Y为氧元素,Z与X同主族,其单质在同周期元素中形成的单质中熔点最高,则Z为硅元素,W原子M能层为全充满状态,且核外的未成对电子只有一个,原子序数小于30,所以W为铜元素,
(1)X、Y、Z分别为C、O、Si,根据元素周期律,同主族从上到下,元素的电负性逐渐减弱,原子半径增大,同周期从左到右,元素的电负性逐渐增大,故三种元素的电负性由大到小的顺序为O>C>Si,所以三种元素的非金属活泼性由强到弱的顺序为O>C>Si,
故答案为:O>C>Si;
(2)Z为硅元素,最外层有4个电子,所以电离能突增应出现在失去第5个电子时,即第五电离能,
故答案为:五;
(3)C的氢化物中C原子的杂化方式为sp2,所以碳原子周围有一个双键,则相对分子质量最小的为乙烯,乙烯分子中有δ键和π键,
故答案为:cd;
(4)W为铜元素,它的价电子排布图为 ;如图丙为铜型晶体的堆积方式,为面心立方堆积,在铜晶胞中,铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,若铜晶体中一个晶胞的边长为a cm,则铜晶体的密度为$\frac{\frac{64×4}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{256}{{a}^{3}{N}_{A}}$g/cm3,
;如图丙为铜型晶体的堆积方式,为面心立方堆积,在铜晶胞中,铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,若铜晶体中一个晶胞的边长为a cm,则铜晶体的密度为$\frac{\frac{64×4}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{256}{{a}^{3}{N}_{A}}$g/cm3,
故答案为: ;$\frac{256}{{a}^{3}{N}_{A}}$g/cm3.
;$\frac{256}{{a}^{3}{N}_{A}}$g/cm3.
点评 本题主要考查了元素周期律、键的极性、电离能、电子排布图、晶胞的计算等知识点,中等难度,解题的关键在于元素的推断.

| A. | H+、A1O2-、Na+、Cl- | B. | 强碱性溶液:Na+、HCO3-、SO42- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
| A. | 只有一种结构 | B. | 有两种同分异构体 | ||
| C. | 属于四面体的空间结构 | D. | 是甲烷的一种同系物 |
| A. | 各种水果之所以有果香味,是因为水果中含有一定的酯类物质 | |
| B. | 苯酚有毒,所以日常所用的药皂中不可能掺入苯酚 | |
| C. | 用浓溴水可以除去苯中少量的苯酚 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
| A. | 4种溶液的PH的大小是③>②>④>① | |
| B. | 若将4种溶液稀释相同的倍数,PH变化最大的是② | |
| C. | 若分别加入25 mL0.1 mol•L-1盐酸后,PH最大的是① | |
| D. | 若4种溶液的PH均为9,则物质的量浓度大小顺序是③>①>②>④ |
| A. | 有2个A原子 | B. | 有2个氧原子 | C. | 有1个A原子 | D. | 有1个氧原子 |
| A. | 相同温度下,AgCl在水中的溶解度大于在氯化钠溶液中的溶解度 | |
| B. | 浓FeCl3溶液滴入沸水加热形成红褐色透明液体 | |
| C. | 自然界地表层原生铜矿变成CuSO4溶液向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS) | |
| D. | 加入少量AgCl固体可以除去氯化钠溶液中的少量硫化钠杂质 |
| A. | 微粒半径:O2-<F-<Na+<Li+ | |
| B. | 第一电离能:C<N<O | |
| C. | 元素的电负性:O>S>N>P | |
| D. | 热稳定性大小:SiH4<PH3<NH3<H2O<HF |
 ;
;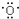 ;
; ,结构式为
,结构式为 .
.