题目内容
【题目】钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业,电真空照明材料等方面。黑钨矿是一种有开采价值的钨矿石,其主要成分是铁和锰的钨酸盐(常用FeWO4、MnWO4表示)。它的传统冶炼工艺的第一阶段如下图所示:
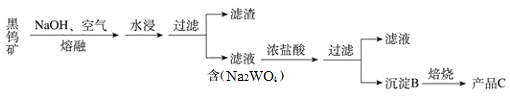
注:①上述流程中钨的化合价不变 ②钨酸(H2WO4)是一种难溶性酸
(1)写出C的化学式:______;写出生成B的化学方程式:_________
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有_________,请写出FeWO4在熔融条件下发生反应生成该成分的化学方程式_________
(3)冶炼金属钨是用非整比的钨氧化物为原料,钨元素在其中存在两种价态:+5价和+6价,试确定组成为WO2.7的氧化钨中两种对应价态的钨原子个数的整数比为_____________。
(4)黑钨矿还含少量Si、As的化合物,上述流程需优化(见下图)。向含Na2WO4的滤液中加硫酸调节pH=10后,再除杂净化。
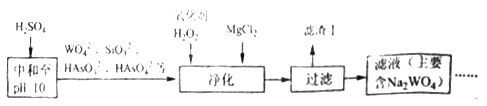
则“净化”过程中,加入H2O2的目的是__________,滤渣Ⅰ的主要成分是____________。
(5)某温度下,Ca(OH)2、CaWO4的相关数据见下表
项目 | CaWO4 | Ca(OH)2 |
-lgc(阴离子) | 4 | 2 |
-lgc(Ca2+) | 6 | 4 |
将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
【答案】 WO3 Na2WO4+2HCl=H2WO4↓+2NaCl Fe2O3 4FeWO4+ O2+ 8NaOH =2Fe2O3↓+4Na2WO4 + 4H2O 3 : 2 (或2 : 3 ) 将含砷化合物氧化以便更好地除去杂质(其它合理解释也可) MgSiO3 MgHAsO4 100
【解析】熔融FeWO4、MnWO4和氢氧化钠在氧气的作用下,反应生成Fe2O3、MnO2和钨酸钠,MnO2和Fe2O3均不溶于水,钨酸钠易溶于水,经过水浸、过滤,滤液为钨酸钠溶液;钨酸钠和浓盐酸反应生成钨酸(B)和氯化钠,化学方程式为:Na2WO4 +2HCl═H2WO4↓+2NaCl;钨酸高温生成氧化钨(C),氢气还原氧化钨生成钨和水,化学方程式为:WO3 +3H2![]() W+3H2O;
W+3H2O;
(1)由分析可知C的化学式为WO3 ;生成B的化学方程式为Na2WO4+2HCl=H2WO4↓+2NaCl;
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有Fe2O3,FeWO4在熔融条件下与NaOH、O2发生反应生成Fe2O3的化学方程式为4FeWO4+ O2+ 8NaOH =2Fe2O3↓+4Na2WO4 + 4H2O;
(3)这种氧化钨中存在五价和六价两种价态的钨,设钨的平均价态为x,则x+(-2)×2.8=0,解得x=+5.6,化合物中正负化合价代数和为零,设每个WO2.8的分子中五价的原子个数为a,六价的原子个数为b,则有5a+6b=5.6和a+b=1解之得,b=0.4,a=0.6,可知这两种价态的钨原子数之比为0.6:0.4=3:2;
(4)H2O2有强氧化性,“净化”过程中,加入H2O2的目的是 将含砷化合物氧化以便更好地除去杂质,滤渣Ⅰ的主要成分是Mg2+与溶液中的SiO32-和HAsO42-生成的不溶物MgSiO3和MgHAsO4 ;
(5)已知CaWO4(s)![]() WO42-(aq)+Ca2+(aq),ksp(CaWO4)=c(WO42-)×c(Ca2+)=1×10-6×1×10-4=1×10-10;Ca(OH)2(s)
WO42-(aq)+Ca2+(aq),ksp(CaWO4)=c(WO42-)×c(Ca2+)=1×10-6×1×10-4=1×10-10;Ca(OH)2(s)![]() 2OH-(aq)+Ca2+(aq),ksp(Ca(OH)2)=c2(OH-)×c(Ca2+)=(1×10-2)2×1×10-4=1×10-8;则WO42-(aq)+Ca(OH)2(s)
2OH-(aq)+Ca2+(aq),ksp(Ca(OH)2)=c2(OH-)×c(Ca2+)=(1×10-2)2×1×10-4=1×10-8;则WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数=ksp(Ca(OH)2)÷ksp(CaWO4)=(1×10-8)÷(1×10-10)=100。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数=ksp(Ca(OH)2)÷ksp(CaWO4)=(1×10-8)÷(1×10-10)=100。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案