题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500 ℃时隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和SO2。
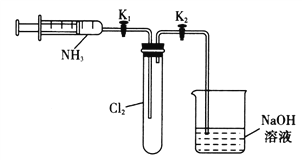
(1)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是__________________________。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________(填字母)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________气体生成,若含有该气体,观察到的现象为_______________________________________。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________a(填“大于”“小于”或“等于”)。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应的离子方程式为______________________
(2)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,实验测定其与16.00mL 0.1000 mol/L KMnO4溶液恰好完全反应。已知(NH4)2Fe(SO4)2·6H2O的摩尔质量是392g/mol,则产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_______________。
【答案】 使分解产生的气体在B、C中被吸收充分 BD SO3 溶液变浑浊 小于 SO2 + H2O2+Ba2+===BaSO4↓+2H+ 62.72%
【解析】(1)①A中固体充分加热较长时间后,通入氮气目的是把反应产生的气体全部在B、C装置中完全吸收;答案为:使分解产生的气体在B、C中被吸收充分;
②为验证A中残留物是否含有FeO,应该先用稀硫酸溶解,然后再用KMnO4溶液检验亚铁离子,答案选BD;
③SO3气体与水反应生成硫酸,硫酸与BaC12溶液的作用产生白色硫酸钡沉淀;答案为: SO3 ; 溶液变浑浊 ;
④A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,根据化合价升降必相等,硫降低的化合价(2a)等于铁升高的化合价(2b)和氮升高的化合价之和,则b小于a;答案选小于;
⑤C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+;答案为:SO2+H2O2+Ba2+=BaSO4↓+2H+;
(2)根据反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O规律:设消耗(NH4)2Fe(SO4)2·6H2O 为xmol;
5Fe2+ ---------MnO4-
x 16.00 0.1000×10-3 解得x=0.008mol;
20.00 g硫酸亚铁铵晶体含有(NH4)2Fe(SO4)2·6H2O的质量0.008×100/25×392=12.544g
产品中(NH4)2Fe(SO4)2·6H2O的质量分数为=12.544/20=62.72%; 答案为62.72%;