题目内容
7.按要求填空.(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是Fe3+、Mg2+、H+,只有还原性的是S2-、I-,既有氧化性又有还原性的是Fe2+、S.
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3---N2O3+H2O
②NH3+NO---HNO2+H2O
③N2O4+H2O---HNO3+HNO2
其中你认为一定不可能实现的是②(填序号).
(3)下列三个氧化还原反应中,氧化性最强的物质是KMnO4.
①2FeCl3+2KI═2FeCl2+2KCl+I2
②2FeCl2+Cl2═2FeCl3
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的FeCl3作氧化剂.
分析 (1)处于元素高价态的微粒只具有氧化性,处于低价态只具有还原性,而处于中间价态的微粒具有氧化性和还原性;
(2)氧化还原反应中一定有元素的化合价升高和降低,且符合归中反应或歧化反应的规律;
(3)含元素化合价降低的物质为氧化剂,结合氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性解答.
解答 解:(1)Fe3+、Mg2+、H+中的化合价都是最高价态,所以都只有氧化性;
S2-、I-中的化合价都是最低价态,所以都只有还原性;
Fe2+、S中的化合价是中间价态,所以既有氧化性又有还原性,
故答案为:Fe3+、Mg2+、H+; I-、S2-;Fe2+、S;
(2)氧化还原反应的特征是元素化合价的升降,②中N元素化合价只升高,不符合,故答案为:②;
(3)由①可知氧化性FeCl3>I2,②Cl2>FeCl3,③KMnO4>Cl2,则氧化性最强的为KMnO4,则若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还可应用上述反应中的FeCl3,
故答案为:KMnO4;FeCl3.
点评 本题综合考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确元素化合价与氧化性和还原性的关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
15.下列不属于配合物的是( )
| A. | [Cu(H2O)4]SO4•H2O | B. | [Ag(NH3)2]OH | C. | KAl(SO4)2•12H2O | D. | Fe(SCN)3 |
2.向一定量的Cu、Fe2O3的混合物在中加入300mL 1mol/L 的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+.若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A. | 6.4 g | B. | 4.8 g | C. | 2.4 g | D. | 1.6 g |
12.下列各物质中的杂质(括号内为杂质),不能用稀盐酸除去的是( )
| A. | NaCl(Na2CO3) | B. | SiO2(CaCO3) | C. | Cu粉(Mg粉) | D. | KNO3(KCl) |
19.某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是下列中的( )
| A. | Fe2+ | B. | Cu2+ | C. | Al3+ | D. | Ba2+ |
17.下列说法正确的是( )
| A. | 苯酚溶液、乙烷、乙烯、乙醇、溴苯4种物质可用溴水一次鉴别 | |
| B. | CH3CH2OH、CH2=CHCOOH、CH3CHO、CH3COOH四种溶液可用新制Cu(OH)2一次鉴别 | |
| C. | 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 | |
| D. | KCl溶液中混有少量KI,可通入足量Cl2后,再用乙醇进行萃取、分液 |
 已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答: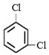
 ;③35Cl、37Cl;
;③35Cl、37Cl; 第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: