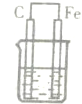
题目内容
在长期载人的太空飞行宇航器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意图如下:

(1)管道①的作用是将飞船座舱中含CO2的空气通入“电化学CO2处理系统”的N极室,通过该电极反应可以使CO2不断被吸收,则N极为______极(填“正”或“负”),其电极反应为:______,其电极产物吸收CO2的离子方程式为______,在N极吸收CO2后形成的阴离子会通过隔膜进入M极室,与M极上产生的产物反应又生成CO2.从电解质溶液中释放出来,并保持系统内pH不变,该电极反应式为______,CO2逸出的离子方程式为______.
(2)管道②的作用是将处理后的空气混入“电解水系统产生的新鲜氧气”,然后通入飞船座舱内供宇航员呼吸.在电解水系统中,Y为______极(填“阴”或“阳”),X极的电极反应式______.
(3)逸出的CO2没有排出飞船外,而是通过管道③进入“CO2还原系统”,在该系统内,CO2跟H2在一定条件下反应,其产物有甲烷等气体,甲烷可作飞船的燃料.已知甲烷的热值为56kJ/g,则甲烷在足量氧气中燃烧生成CO2和液态水的热化学方程式______.

(1)管道①的作用是将飞船座舱中含CO2的空气通入“电化学CO2处理系统”的N极室,通过该电极反应可以使CO2不断被吸收,则N极为______极(填“正”或“负”),其电极反应为:______,其电极产物吸收CO2的离子方程式为______,在N极吸收CO2后形成的阴离子会通过隔膜进入M极室,与M极上产生的产物反应又生成CO2.从电解质溶液中释放出来,并保持系统内pH不变,该电极反应式为______,CO2逸出的离子方程式为______.
(2)管道②的作用是将处理后的空气混入“电解水系统产生的新鲜氧气”,然后通入飞船座舱内供宇航员呼吸.在电解水系统中,Y为______极(填“阴”或“阳”),X极的电极反应式______.
(3)逸出的CO2没有排出飞船外,而是通过管道③进入“CO2还原系统”,在该系统内,CO2跟H2在一定条件下反应,其产物有甲烷等气体,甲烷可作飞船的燃料.已知甲烷的热值为56kJ/g,则甲烷在足量氧气中燃烧生成CO2和液态水的热化学方程式______.
(1)含CO2的空气通入“电化学CO2处理系统”的N极室,N极上氧气得电子为正极,电极反应为2H2O+O2+4e-=4OH-,吸收CO2的离子方程式为2OH-+CO2=CO32-+H2O,M极上氢起失去电子,该电极反应为H2+2e-=2H+,氢离子与碳酸根离子反应生成二氧化碳和水,所以CO2逸出的离子方程式为2H++CO32-=CO2+H2O,
故答案为:正;2H2O+O2+4e-=4OH-;2OH-+CO2=CO32-+H2O;H2+2e-=2H+;2H++CO32-=CO2+H2O;
(2)由图可知,Y极上氢离子得到电子生成氢气,为阴极,而X极上氢氧根离子失去电子生成氧气,电极反应为4OH--4e-=2H2O+O2↑(或2H2O-4e-=4H++O2↑),
故答案为:阴;4OH--4e-=2H2O+O2↑(或2H2O-4e-=4H++O2↑);
(3)甲烷的热值为56kJ/g,则燃烧热为△H=-56kJ/mol×16g/mol=-896kJ/mol,注明物质的状态可知热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896kJ/mol,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896kJ/mol.
故答案为:正;2H2O+O2+4e-=4OH-;2OH-+CO2=CO32-+H2O;H2+2e-=2H+;2H++CO32-=CO2+H2O;
(2)由图可知,Y极上氢离子得到电子生成氢气,为阴极,而X极上氢氧根离子失去电子生成氧气,电极反应为4OH--4e-=2H2O+O2↑(或2H2O-4e-=4H++O2↑),
故答案为:阴;4OH--4e-=2H2O+O2↑(或2H2O-4e-=4H++O2↑);
(3)甲烷的热值为56kJ/g,则燃烧热为△H=-56kJ/mol×16g/mol=-896kJ/mol,注明物质的状态可知热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896kJ/mol,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896kJ/mol.

练习册系列答案
相关题目
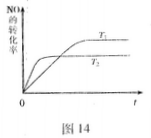
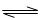 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)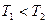 )
)