题目内容
下列溶液一定呈中性的是 ( )。
| A.c(H+)=c(OH-)=10-6 mol·L-1的溶液 |
| B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
A
解析

练习册系列答案
相关题目
常温下,向l00mL0.01mol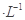 HA溶液中逐滴加入0.02mol
HA溶液中逐滴加入0.02mol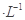 MOH溶液,如图所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是:
MOH溶液,如图所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是: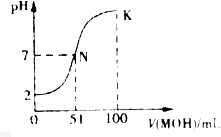
| A.HA为一元强酸 |
| B.MOH为一元弱碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应的溶液的PH=10,则有c(MOH)+ c(OH-)- c(H+)=0.005mol/L |
下列选项正确的是
| A.0.l mol·L-1的NaHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| B.等物质的量浓度的三种溶液:①(NH4)2CO3②NH4Cl ③(NH4)2Fe(SO4)2中,c(NH4+)的大小顺序为:③>②>① |
| C.25℃时,pH=4的KHC2O4溶液中:c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| D.CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是 ( )
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入NH4Cl固体 ⑤向水中加入NaHCO3固体 ⑥向水中加入NaHSO4固体
| A.①②⑤ | B.①④ | C.③④⑥ | D.④ |
用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是 ( )。
| A.c(OH-)/c(NH3·H2O) |
| B.c(NH3·H2O)/c(OH-) |
| C.n(OH-)和c(H+) |
| D.c(H+)和c(OH-)的乘积 |
某同学取等体积的稀盐酸与稀醋酸各一份进行稀释,下面是稀释前后的有关数据及结论,其中肯定错误的是 ( )
| | A | B | C | D |
| 稀释前 | 酸浓度相同 | 酸浓度相同 | pH均为3 | pH均为3 |
| 稀释量 | 均为10倍 | 稀释至两酸pH相同 | 稀释至pH均为5 | 均为100倍 |
| 结论 | pH:盐酸的小 | 稀释倍数:盐酸的大 | 稀释倍数:盐酸的大 | pH:盐酸的大 |
室温下,取0.3 mol·L-1HY溶液与0.3 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是 ( )
| A.混合溶液中由水电离出的c(OH-)=10-9 mol·L-1 |
| B.溶液中离子浓度由大到小的顺序为c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.混合溶液中c(Na+)=c(Y-)+c(HY)=0.3 mol·L-1 |
| D.混合溶液中c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1 |
25℃时,将a mol·L-1一元酸HA与b mol·L-1 NaOH等体积混合后测得溶液pH=7,则下列关系一定不正确的是( )
| A.a=b | B.a>b |
| C.c(A-)=c(Na+) | D.c(A-)<c(Na+) |

 H+ + HA-;HA—
H+ + HA-;HA—  H+ + A2-
H+ + A2-