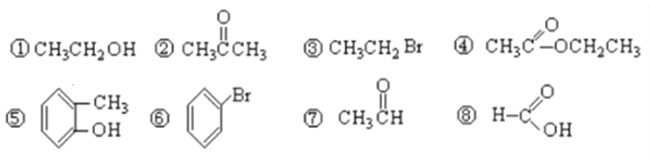
题目内容
【题目】A、B、C为短周期元素,在周期表中所处位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。

(1)写出元素名称:A_________、B_________、C_________。
(2)B位于元素周期表第_________周期第_________族。
(3)比较B、C的原子半径:B___________C。写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式________________________。
【答案】氮 硫 氟 第3周期 第VIA族 B>C 2NH3+H2SO4==(NH4)2SO4
【解析】
A、B、C为短周期元素,由元素所处位置可知,A、C处于第二周期,B处于第三周期,设B元素的质子数为x,则A的核外电子数为x-9,C的核外电子数为x-7,可得x-9+x-7=x,解之得x=16,所以A的质子数为7,B的质子数为16,C的质子数为9,则A、B、C分别为N、S、F元素,据此解答。
A、B、C为短周期元素,由元素所处位置可知,A、C处于第二周期,B处于第三周期,设B元素的质子数为x,则A的核外电子数为x-9,C的核外电子数为x-7,可得x-9+x-7=x,解之得x=16,所以A的质子数为7,B的质子数为16,C的质子数为9,则A、B、C分别为N、S、F元素,
(1)由上述分析可知,A为氮、B为硫、C为氟;
(2)B为硫,位于元素周期表第三周期第VIA族;
(3)同主族元素从上而下原子半径依次增大,故S>O;同周期元素从左而右原子半径依次减小,故O>F,因此B、C的原子半径:B>C;A的气态氢化物NH3与B的最高价氧化物对应的水化物H2SO4反应生成硫酸铵,反应的化学方程式为2NH3+H2SO4=(NH4)2SO4。