��Ŀ����
���Ṥҵ�Ļ����ǰ��Ĵ��������ڴ��������·������·�Ӧ��
��4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ/mol ������Ӧ
��4NH3��g��+3O2��g��?2N2��g��+6H2O��g����H=-1268kJ/mol �ڸ���Ӧ
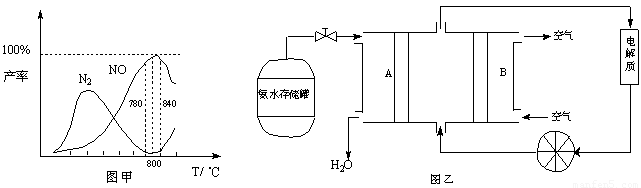
�й����ʲ������¶ȵĹ�ϵ���ͼ��
��1���ɷ�Ӧ�٢ڿ�֪��Ӧ��N2��g��+O2��g��?2NO��g���ķ�Ӧ�ȡ�H=______
��2����ͼ��֪��ҵ�ϰ����������� NOʱ����Ӧ�¶���ÿ�����______
��3����Fe3O4�Ʊ�Fe��NO3��3��Һʱ����ӹ�����ϡ���ᣬԭ��һ����Fe4O3�е�Fe2+ȫ��ת��ΪFe3+��ԭ�����______�������ֺ����ӷ���ʽ˵������
��4����NH3ͨ��NaClO��Һ�У�������N2H4����Ӧ�����ӷ���ʽΪ______��
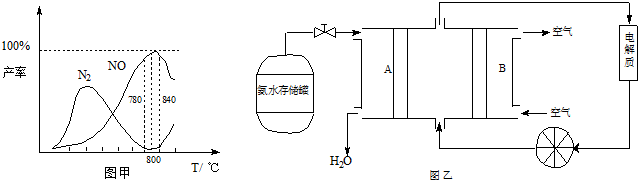
��5�����ݷ�Ӧ�ڿ�����Ƴ�ֱ�ӹ���ʽ����ȼ�ϵ�أ�����ͼ��ʾ������ͼ��AΪ______��������������������缫����ʽΪ______��
��4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ/mol ������Ӧ
��4NH3��g��+3O2��g��?2N2��g��+6H2O��g����H=-1268kJ/mol �ڸ���Ӧ
�й����ʲ������¶ȵĹ�ϵ���ͼ��

��1���ɷ�Ӧ�٢ڿ�֪��Ӧ��N2��g��+O2��g��?2NO��g���ķ�Ӧ�ȡ�H=______
��2����ͼ��֪��ҵ�ϰ����������� NOʱ����Ӧ�¶���ÿ�����______
��3����Fe3O4�Ʊ�Fe��NO3��3��Һʱ����ӹ�����ϡ���ᣬԭ��һ����Fe4O3�е�Fe2+ȫ��ת��ΪFe3+��ԭ�����______�������ֺ����ӷ���ʽ˵������
��4����NH3ͨ��NaClO��Һ�У�������N2H4����Ӧ�����ӷ���ʽΪ______��
��5�����ݷ�Ӧ�ڿ�����Ƴ�ֱ�ӹ���ʽ����ȼ�ϵ�أ�����ͼ��ʾ������ͼ��AΪ______��������������������缫����ʽΪ______��
��1���ɸ�˹���ɣ�����-�ڣ���
�ɵ�N2��g��+O2��g��?2NO��g�����ʡ�H=
��[��-905kJ/mol��-��-1258kJ/mol��]=+181.5 kJ/mol��
�ʴ�Ϊ��+181.5 kJ/mol��
��2����ͼ����Կ��ڣ���Ӧ�¶���780��840�棬NO�IJ������ѡ��780��840�棬
�ʴ�Ϊ��780��840�棻
��3����Һ��������ˮ��Fe3++3H2O?Fe��OH��3+3H+����������������Fe3+��ˮ�⣬
�ʴ�Ϊ����Һ��������ˮ��Fe3++3H2O?Fe��OH��3+3H+����������������Fe3+��ˮ�⣻
��4��NH3ͨ��NaClO��Һ�У�����N2H4��NԪ�صĻ��ϼ����ߣ���ClԪ�صĻ��ϼ�Ӧ���ͣ������������ɣ�����Ԫ���غ������غ��֪������ˮ���ɣ���ƽ�����ӷ���ʽΪ��2NH3+ClO-=N2H4+Cl-+H2O��
�ʴ�Ϊ��2NH3+ClO-=N2H4+Cl-+H2O��
��5����ͼ��֪��A��ͨ���Ϊ����������������Ӧ��Ϊ�����������ڼ��������·ŵ����ɵ�����ˮ���缫��ӦʽΪ��2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ��������2NH3-6e-+6OH-=N2+6H2O��
| 1 |
| 2 |
| 1 |
| 2 |
�ʴ�Ϊ��+181.5 kJ/mol��
��2����ͼ����Կ��ڣ���Ӧ�¶���780��840�棬NO�IJ������ѡ��780��840�棬
�ʴ�Ϊ��780��840�棻
��3����Һ��������ˮ��Fe3++3H2O?Fe��OH��3+3H+����������������Fe3+��ˮ�⣬
�ʴ�Ϊ����Һ��������ˮ��Fe3++3H2O?Fe��OH��3+3H+����������������Fe3+��ˮ�⣻
��4��NH3ͨ��NaClO��Һ�У�����N2H4��NԪ�صĻ��ϼ����ߣ���ClԪ�صĻ��ϼ�Ӧ���ͣ������������ɣ�����Ԫ���غ������غ��֪������ˮ���ɣ���ƽ�����ӷ���ʽΪ��2NH3+ClO-=N2H4+Cl-+H2O��
�ʴ�Ϊ��2NH3+ClO-=N2H4+Cl-+H2O��
��5����ͼ��֪��A��ͨ���Ϊ����������������Ӧ��Ϊ�����������ڼ��������·ŵ����ɵ�����ˮ���缫��ӦʽΪ��2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ��������2NH3-6e-+6OH-=N2+6H2O��

��ϰ��ϵ�д�
�����Ŀ
���Ṥҵ�Ļ����ǰ��Ĵ��������ڴ��������·������·�Ӧ��
�� 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ��H = ��905 kJ/mol ������Ӧ
4NO(g)+6H2O(g) ��H = ��905 kJ/mol ������Ӧ
�� 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ��H = ��1268 kJ/mol �ڸ���Ӧ
2N2(g)+6H2O(g) ��H = ��1268 kJ/mol �ڸ���Ӧ
�й����ʲ������¶ȵĹ�ϵ���ͼ��
 |
��1���ɷ�Ӧ�٢ڿ�֪��Ӧ��N2(g) + O2(g) ![]() 2NO(g)�ķ�Ӧ�Ȧ�H= ��
2NO(g)�ķ�Ӧ�Ȧ�H= ��
��2����ͼ��֪��ҵ�ϰ����������� NOʱ����Ӧ�¶���ÿ����� ��
��3����Fe3O4�Ʊ�Fe��NO3��3��Һʱ����ӹ�����ϡ���ᣬԭ��һ����Fe4O3�е�Fe2+ȫ��ת��ΪFe3+��
ԭ����� �� �������ֺ����ӷ���ʽ˵������
��4����NH3ͨ��NaClO��Һ�У�������N2H4����Ӧ�����ӷ���ʽΪ �� ��
��5�����ݷ�Ӧ�ڿ�����Ƴ�ֱ�ӹ���ʽ����ȼ�ϵ�أ�����ͼ��ʾ������ͼ��AΪ �� ��������������������缫����ʽΪ ��

 4NO(g)+6H2O(g)
��H = ��905
kJ/mol ������Ӧ
4NO(g)+6H2O(g)
��H = ��905
kJ/mol ������Ӧ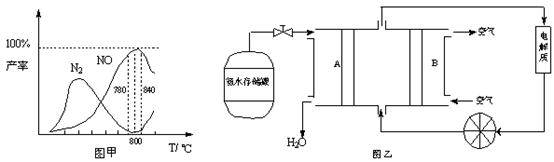
 4NO(g)+6H2O(g) ��H =
��905 kJ/mol ������Ӧ
4NO(g)+6H2O(g) ��H =
��905 kJ/mol ������Ӧ