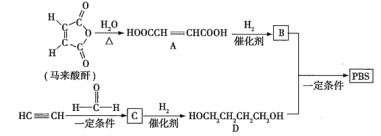
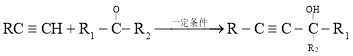
题目内容
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置 _________ ![]() 的中子数为______________________。
的中子数为______________________。
(2)热稳定性:NH3______________________PH3(填“>”或“<”)。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是 ____________(填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
【答案】第四周期第ⅤA族 173 > b
【解析】
既然这五种元素都位于第![]() 族,则它们的化学性质相近,非金属性从上到下依次减弱,金属性依次增强,据此来分析本题即可。
族,则它们的化学性质相近,非金属性从上到下依次减弱,金属性依次增强,据此来分析本题即可。
(1)砷为第四周期第![]() 族元素,
族元素,![]() 的中子数为288-115=173;
的中子数为288-115=173;
(2)非金属性越强的元素,其气态氢化物的热稳定性越强,而氮元素的非金属性强于磷,故热稳定性有NH3>PH3;
(3)由NH3与HI反应生成NH4I,类推PH3与HI反应生成PH4I,再来分析选项:
a.NH4I可以和烧碱发生复分解反应,则PH4I应该也能和烧碱反应,a项错误;
b.NH4I含离子键、共价键,类推PH4I含离子键、共价键,b项正确;
c.NH4I不与水发生反应,则PH4I应该也不能和水反应,c项错误;
答案选b。

【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol-1)___________。
(2)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选项中选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。