题目内容
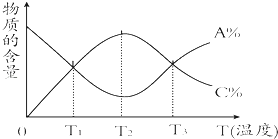
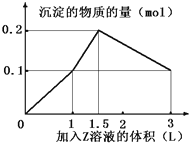
【题目】某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如下图,则符合条件的X、Y、Z分别是
A. 偏铝酸钠、氯化钡、硫酸 B. 偏铝酸钠、氢氧化钡、硫酸
C. 氯化铝、氯化铁、氢氧化钠 D. 氯化铝、氯化镁、氢氧化钠
【答案】B
【解析】A、发生的反应是AlO2-+H++H2O=Al(OH)3↓、Ba2++SO42-=BaSO4↓、Al(OH)3+3H+=Al3++3H2O,全部生成氢氧化铝0.1mol,需要硫酸0.05mol,生成沉淀BaSO40.05mol,需要消耗硫酸0.05mol,因此生成0.1mol沉淀时消耗硫酸的体积为0.5L,故第一段直线不符合,故A错误;B、发生的反应是OH-+H+=H2O、Ba2++SO42-=BaSO4↓、H++AlO2-+H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,图中第一段直线:氢氧化钡中的OH-和硫酸中H+1:1中和,同时Ba2+和SO42-按照1:1反应生成硫酸钡沉淀,发生的反应是Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,图中第二段直线,氢氧化钡消耗完,硫酸继续滴加,H+与AlO2-反应:H++AlO2-+H2O=Al(OH)3↓,硫酸的消耗量和沉淀生成量是1:2,图中第三段直线:硫酸进一步过量,发生Al(OH)3+3H+=Al3++3H2O,硫酸和沉淀消耗量是1.5:1,直到氢氧化铝完全溶解,沉淀只剩下BaSO4,以上三段符合图像的数值变化,故B正确;C、滴入氢氧化钠,发生Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,n(Al3+):n(OH-)=1:3,n(Fe3+):n(OH-)=1:3,继续滴加氢氧化钠,发生Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)1:1,不符合图像的数值变化,故C错误;D、滴入氢氧化钠:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,n(Mg2+):n(OH-)=1:2,n(Al3+):n(OH-)=1:3,继续滴入NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,不符合图像的数值变化,故D错误。