题目内容
【题目】I.如图所示为常见玻璃仪器的部分结构:
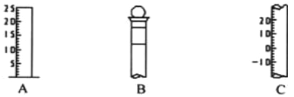
(1)请写出所列仪器的名称: A______,B_______,C_______;
(2)仪器 B 使用前必须__________________。
(3)仪器 B 上标记有______(填序号);①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II.已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:
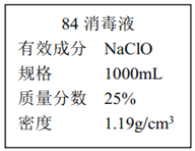
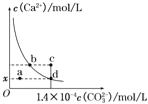
(1)该“84 消毒液”的物质的量浓度约为_______mol·L-1。(保留两位有效数字)
(2)某同学取100 mL该“84 消毒液”,稀释后用于消毒,稀释后的溶液中 c (Na+)=_____。
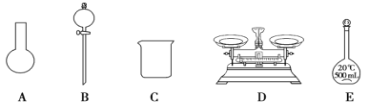
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确的是________(填序号)。
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
(4) “84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为______ mL。
【答案】量筒 容量瓶 温度计 检查是否漏液 ②③⑤ 4.0 0.04 mol·L-1 ab 250
【解析】
Ⅰ、根据仪器的结构结合图示分析判断;II.(1)根据含25%NaClO、1000mL、密度1.19gcm-3,结合c=![]() 来计算;(2)根据稀释前后溶质的物质的量不变来计算;(3)根据溶液的配制过程及c=
来计算;(2)根据稀释前后溶质的物质的量不变来计算;(3)根据溶液的配制过程及c=![]() 、m=nM来分析;据此分析解答。
、m=nM来分析;据此分析解答。
Ⅰ.(1)根据仪器的图形可知:A为量筒,B为容量瓶、C为温度计,故答案为:量筒;容量瓶;温度计;
(2)容量瓶口部有塞子,在使用前必须要检查是否漏水,故答案为:检查是否漏液;
(3)B为容量瓶,容量瓶上标记有:温度、刻度线、容积,故答案为:②③⑤;
II.(1)c(NaClO)=c=![]() =
=![]() =4.0 molL-1,故答案为:4.0;
=4.0 molL-1,故答案为:4.0;
(2)稀释后c(NaClO)=![]() ×4.0 molL-1=0.04 molL-1,c(Na+)=c(NaClO)=0.04 molL-1,故答案为:0.04 mol·L-1;
×4.0 molL-1=0.04 molL-1,c(Na+)=c(NaClO)=0.04 molL-1,故答案为:0.04 mol·L-1;
(3)a.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B两种不需要,但还需玻璃棒和胶头滴管,故a错误;b.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干即可使用,故b错误;c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,导致部分溶质残留在烧杯中,使得溶质的物质的量偏少,导致结果偏低,故c正确;故答案为:ab;
(4)溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=![]() =18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=2L×2.3mol/L,解得:V=0.25L=250mL,故答案为:250。
=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=2L×2.3mol/L,解得:V=0.25L=250mL,故答案为:250。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】资料显示“O2 的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应。实验如下:
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2mL1mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2mL1mol/LKI 溶液+5滴淀粉+1mL0.1mol/L HCl | 溶液变蓝 | |
③2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol/L KCl | 无明显变化 | |
④2mL1mol/LKI溶液+5滴淀粉+1mL0.1mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
下列说法不正确的是
A. 通过小烧杯中溶液颜色的变化证明反应的发生
B. ③是验证Cl-是否影响KI与O2的反应
C. ④说明CH3COOH 是弱酸,因为和盐酸同浓度同温度的情况下,电离出 c(H+)浓度低
D. 此实验还可以增加2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol·L-1NaOH 溶液这一步骤