��Ŀ����
����Ŀ����ҵ��ұ����ͭ��mCu2OnFeS���ɵõ���ͭ����ͭ���ᷴӦ�����������⣨��ͼ1�������������գ� 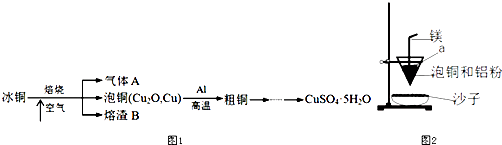
��1������A�еĴ�����Ⱦ���ѡ�������Լ��е�������ţ����գ�
a��ŨH2SO4 b��ŨHNO3 c��NaOH��Һ d����ˮ
��2��ʵ���ҿ�����ͼ2��װ�������ͭұ����ͭ�ķ�Ӧ��
����ͭұ����ͭ�Ļ�ѧ����ʽ����
��װ����þ������������
����ͭ�����ۻ������渲��������ɫ����a��a����
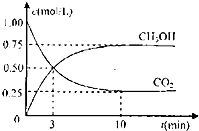
��3����H2S��O2���ܱ������е�ȼ����ַ�Ӧ��ָ���ԭ�����¶Ⱥ�ѹǿ��120�桢101kPa���������������30%����ԭ�����������H2S��������� �� ��������H2S�������ֽ⣩��֪����������ʱ��2H2S+O2 ![]() 2S+2H2O ��������ʱ��2H2S+3O2�T2SO2+2H2O��
2S+2H2O ��������ʱ��2H2S+3O2�T2SO2+2H2O��
��4����֪��SiCl4��s��+H2��g���TSiHCl3��s��+HCl��g����H1=47kJ/mol
SiHCl3��s��+H2��g���TSi��s��+3HCl��g����H2=189kJ/mol
����SiCl4�Ʊ�����Ȼ�ѧ����ʽΪ ��
���𰸡�
��1��cd
��2��3Cu2O+2Al ![]() 6Cu+Al2O3��ȼ�շų��������ȣ�������»���������ȼ����������أ���KClO3��
6Cu+Al2O3��ȼ�շų��������ȣ�������»���������ȼ����������أ���KClO3��
��3��0.6��0.7
��4��SiCl4��s��+2H2��g��=Si��s��+4HCl��g����H=+236kJ/mol
���������⣺��1.������AΪSO2 �� ���ü�Һ���գ���Ӧ��NaOH��ˮ�����Դ��ǣ�cd��
��2.����3Cu2O��Al�ڸ����·�Ӧ����Cu��Al2O3 �� ��Ӧ�ķ���ʽΪ3Cu2O+2Al ![]() 6Cu+Al2O3 ��
6Cu+Al2O3 ��
���Դ��ǣ�3Cu2O+2Al ![]() 6Cu+Al2O3��
6Cu+Al2O3��
��þ������ȼ���ã�ȼ�շų��������ȣ�������»����������������ȼ��������������������þ��ȼ�գ�
���Դ��ǣ�ȼ�շų��������ȣ�������»���������ȼ������
�۰�ɫ����Ϊ����أ���KClO3�������Դ��ǣ�����أ���KClO3����
��3.��2H2S+O2=2S+2H2O��a�� 2H2S+3O2=2SO2+2H2O��b����
�ɷ�Ӧ֪����H2S��O2��2��1ʱ������a�����У�����������ܼ���30%��
��2��1��H2S��O2��2��3ʱ���з�Ӧ��a�����з�Ӧ��b��������������ܼ���30%��
��ԭ���������H2S��O2�ֱ�Ϊx��yL��
2H2S | + | O2 | = | 2S | + | 2H2O | ����������� |
2y | y | 2y | y |
�� ![]() =0.3
=0.3 ![]() =
= ![]()
�� ![]() =0.7��
=0.7��
xH2S + yO2=��y�� ![]() ��SO2+��1.5x��y��S+xH2O �����������
��SO2+��1.5x��y��S+xH2O �����������
x y ��y�� ![]() ��
�� ![]()
�� ![]() =0.3
=0.3 ![]() =
= ![]()
�� ![]() =0.6
=0.6
���Դ��ǣ�0.6��0.7��
��4.����SiCl4��s��+H2��g���TSiHCl3��s��+HCl��g����H1=47kJ/mol
��SiHCl3��s��+H2��g���TSi��s��+3HCl��g����H2=189kJ/mol
�ɸ�˹���ɿ�֪��+�ڵõ�SiCl4��s��+2H2��g��=Si��s��+4HCl��g������H�T+236kJ/mol��
����SiCl4�Ʊ�����Ȼ�ѧ����ʽΪSiCl4��s��+2H2��g��=Si��s��+4HCl��g����H=+236kJ/mol��
���Դ��ǣ�SiCl4��s��+2H2��g��=Si��s��+4HCl��g����H=+236kJ/mol��