题目内容
【题目】下列叙述正确的是
A. N2的摩尔质量为18g B.等物质的量的O2和O3中所含的氧原子数相同
C. 44g CO2的体积为22.4L D.4.9 g H2SO4中含0.05NA个H2SO4分子
【答案】D
【解析】
试题分析:A.摩尔质量的单位是g/mol,A错误;B. 等物质的量的O2和O3中所含的氧原子数不同,B错误;C.标准状况下44g CO2的体积为22.4L,C错误;D. 4.9 g H2SO4中含0.05NA个H2SO4分子,D正确。故答案D。

 53随堂测系列答案
53随堂测系列答案【题目】(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量(用n(H2)表示)对N2(g)+3H2(g) ![]() 2NH3(g) ΔH < 0反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g) ΔH < 0反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
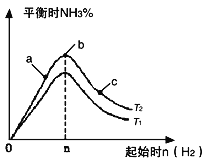
① 比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是_____________;
② 若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,H2与 N2物质的量之比为3∶1,则在起始时体系中加入N2的物质的量为___________mol,此条件下(T2),反应的平衡常数K = ______________;
③ 图像中T2和T1的关系是T2_____________ T1(填“高于”、“低于”、“等于”、“无法确定”)。
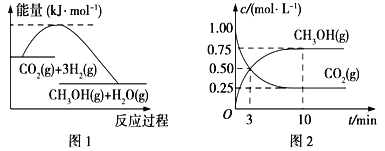
(2)N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2 N2O5 (g)4NO2(g)+O2(g)△H>0T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/molL-1 | 5.00 | 3.52 | 2.50 | 2.50 |
①达平衡后其他条件不变,将容器的体积压缩到原来的![]() ,则c(N2O5)_______(填“大于”、“小于”、“等于”、“无法确定”)5.00molL-1
,则c(N2O5)_______(填“大于”、“小于”、“等于”、“无法确定”)5.00molL-1
②500s内N2O5分解速率为 ____________;
③T1温度下 平衡时N2O5的转化率为____________;
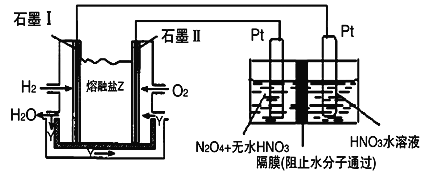
(3)现以H2、O2与熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
写出石墨II电极上发生反应的电极反应式__________________ 。
在电解池中生成N2O5的电极反应式为__________________ 。