��Ŀ����
����Ŀ��ʵ�� �����ܼ��š� �͡���̼���á���һ����Ҫ���������ν�CO2ת��Ϊ�����õ���Դ��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���һ�������·�����Ӧ��
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��
CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��
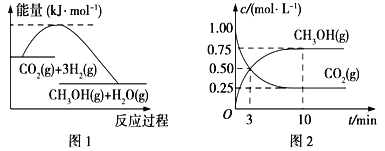
��1�����ڸ÷�Ӧ������˵���У���ȷ����____________(����ĸ)��
A.��H��0����S��0 B.��H��0����S��0
C.��H��0����S��0 D.��H��0����S��0
��2��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊl L���ܱ������У�����l mol CO2��4mol H2��һ�������·�����Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
�ٴӷ�Ӧ��ʼ��ƽ�⣬CO2��ƽ����Ӧ����v(CO2)��_________��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ�����___________(����ĸ)��
A.�����¶�B.��CH3OH(g)��ʱҺ�����C.ѡ���Ч����D.�ٳ���l molCO2��4 molH2
��3��25�棬1.01��105Paʱ��16g Һ̬�״���ȫȼ�գ����ָ���ԭ״̬ʱ���ų�363.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ��_____________��
��4��ѡ�ú��ʵĺϽ�Ϊ�缫�����������ơ��״���ˮ������Ϊԭ�ϣ������Ƴ�һ���Լ״�Ϊԭ�ϵ�ȼ�ϵ�أ��˵�صĸ����ĵ缫��Ӧʽ�ǣ�______________��
���𰸡�C0.075mol/��Lmin��BDCH3OH��l��+![]() O2��g����CO2��g��+2H2O��l�� ��H=��726.6kJ/molCH3OH��6e��+8OH��=CO32��+6H2O��
O2��g����CO2��g��+2H2O��l�� ��H=��726.6kJ/molCH3OH��6e��+8OH��=CO32��+6H2O��
��������������������������̼���ۺ�����Ϊ���忼�黯ѧ��Ӧ�ķ���ѧ��Ӧ���ʺͻ�ѧƽ�⣬�Ȼ�ѧ����ʽ����д��ԭ���ԭ����Ӧ�á��缫��Ӧʽ����д�ȣ���Ŀ�Ѷ��еȡ������ػ���֪ʶ��������
��1�����ݷ�Ӧ��ͼ������жϣ�CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g������������ʵ������٣���Ӧ���ؼ��ٵķ�Ӧ��S��0����Ӧ������������������������жϷ�Ӧ�Ƿ��ȷ�Ӧ����H��0���ʴ�ΪC��
CH3OH��g��+H2O��g������������ʵ������٣���Ӧ���ؼ��ٵķ�Ӧ��S��0����Ӧ������������������������жϷ�Ӧ�Ƿ��ȷ�Ӧ����H��0���ʴ�ΪC��
��2����������̼�Ƿ�Ӧ���淴Ӧ����Ũ�ȼ�С���״���������淴Ӧ����Ũ������10nim�ڴﵽƽ�⣬���ɼ״�Ũ��Ϊ0.75mol/L��������̼Ũ�ȱ仯��0.75mol/L������v��CH3OH��=0.075mol/L��10min=0.075mol/��Lmin ������A����Ӧ�Ƿ��ȷ�Ӧ������ƽ��������У���A����B����CH3OH��g����ʱҺ���������С�����������ƽ��������У���B��ȷ��C��ѡ���Ч����ֻ�ܸı����ʣ����ı仯ѧƽ�⣬��C����D���ٳ���l molCO2��4molH2������ѹǿƽ��������У���D��ȷ��ѡBD��
��3��25����1.01��105Paʱ��16g�����ʵ���Ϊ16g��32g/mol=0.5mol��Һ̬�״���ȫȼ�գ����ָ���ԭ״̬ʱ���ų�363.3kJ����������1mol�״���ȫȼ�ջָ���ԭ״̬ʱ���ų�����726.6kJ���ʼ״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH��l��+3/2O2��g����CO2��g��+2H2O��l����H=��726.6kJ/mol��
��4�����������ơ��״���ˮ������Ϊԭ���Ƴɵ�ȼ�ϵ�أ��״��ڸ����Ϸ���������Ӧ����̼�����ˮ�������Һ�����������ԭ���غ�͵���غ���ƽ�������ĵ缫��Ӧʽ��CH3OH��6e��+8OH��=CO32��+6H2O��

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д� �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�