题目内容
【题目】甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
(1)钢铁因甲而生锈时的正极反应式为 .
(2)若乙是难溶于水的酸性氧化物.则
①R的原子结构示意图 .
②乙的一种重要用途是 .
(3)若丙是离子化合物,且阴离子含金属元素R.
①工业上由乙制取R的单质伴随的能量主要转化形式是:能转化为能.
②R的单质与MnO2反应的化学方程式为 .
③染料工业排放的废水中含有大量有毒的NO2,可以在碱性条件下加入R的单质除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2(有丙的阴离子生成)的离子方程式为 .
【答案】
(1)2H2O+4e﹣+O2=4OH﹣
(2)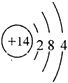 ;制造光导纤维或生产玻璃等
;制造光导纤维或生产玻璃等
(3)电;化学;4Al+3MnO2 ![]() 2Al2O3+3Mn;2Al+OH﹣+NO2﹣+2H2O=2AlO2﹣+NH3 . H2O
2Al2O3+3Mn;2Al+OH﹣+NO2﹣+2H2O=2AlO2﹣+NH3 . H2O
【解析】解:甲是一种导致钢铁生锈及许多还原性物质变质的单质,则甲为O2 , 化合物乙、丙、丁均含有第三周期一种相同元素R.
(1.)钢铁因甲而生锈时,正极上发生还原反应,氧气在正极获得电子生成氢氧根离子,正极电极反应式为:2H2O+4e﹣+O2=4OH﹣ , 所以答案是:2H2O+4e﹣+O2=4OH﹣;
(2.)若乙是难溶于水的酸性氧化物,则乙为SiO2 , 结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3 , 则:①R为Si元素,原子结构示意图为  ,②乙为二氧化硅,可以制造光导纤维或生产玻璃等,所以答案是:
,②乙为二氧化硅,可以制造光导纤维或生产玻璃等,所以答案是:  ;制造光导纤维或生产玻璃等;
;制造光导纤维或生产玻璃等;
(3.)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3 , 丁为Al(OH)3 , 则:①工业上电解熔融的氧化铝冶炼Al,则制取Al的单质伴随的能量主要转化形式是:电能转化为化学能,所以答案是:电;化学;②Al的单质与MnO2反应的化学方程式为:4Al+3MnO2 ![]() 2Al2O3+3Mn,所以答案是:4Al+3MnO2
2Al2O3+3Mn,所以答案是:4Al+3MnO2 ![]() 2Al2O3+3Mn;③染料工业排放的废水中含有大量有毒的NO2﹣ , 可以在碱性条件下加入Al的单质除去,加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体,生成氨气,有丙的阴离子生成,即还生成偏铝酸根,该反应的离子方程式为:2Al+OH﹣+NO2﹣+2H2O=2AlO2﹣+NH3 . H2O,所以答案是:2Al+OH﹣+NO2﹣+2H2O=2AlO2﹣+NH3 . H2O.
2Al2O3+3Mn;③染料工业排放的废水中含有大量有毒的NO2﹣ , 可以在碱性条件下加入Al的单质除去,加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体,生成氨气,有丙的阴离子生成,即还生成偏铝酸根,该反应的离子方程式为:2Al+OH﹣+NO2﹣+2H2O=2AlO2﹣+NH3 . H2O,所以答案是:2Al+OH﹣+NO2﹣+2H2O=2AlO2﹣+NH3 . H2O.

 53随堂测系列答案
53随堂测系列答案【题目】过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质物理量正确的是(NA表示阿伏加德罗常数) ( )
二氧化碳 | 碳酸钠 | 转移的电子 | |
A | 0.5mol | NA | |
B | 53g | 0.5mol | |
C | 53g | NA | |
D | 11.2L | 0.5mol |
A.A
B.B
C.C
D.D
