题目内容
下列说法正确的是( )
| A、在100℃、101 kPa条件下,液态水的气化热为40.69 kJ?mol-1,则H2O(g)?H2O(l)的△H=-40.69 kJ?mol-1 | ||||||||||
| B、在25℃、101kPa,2mol S的燃烧热是1mol S的燃烧热2倍 | ||||||||||
| C、CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-akJ?mol-1,这里△H代表燃烧热 | ||||||||||
D、已知:
 (g)+3H2(g)→ (g)+3H2(g)→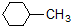 (g)-384 kJ?mol-1 (g)-384 kJ?mol-1 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、水的汽化热是指1mol液态水变为气态吸收的热量;
B、燃烧热是1mol可燃物完全燃烧放出的热量;
C、燃烧热是可燃物完全燃烧放出的热量;
D、△H=反应物键能和-生成物键能和;
B、燃烧热是1mol可燃物完全燃烧放出的热量;
C、燃烧热是可燃物完全燃烧放出的热量;
D、△H=反应物键能和-生成物键能和;
解答:
解:A、水的汽化热是指1mol液态水变为气态吸收的热量,则1mol水蒸气变为液态水放热与之数值相等,符号相反,故A正确;
B、燃烧热是1mol可燃物完全燃烧放出的热量,每种物质的燃烧热个定值,故B错误;
C、H燃烧生成液态水时才是燃烧热,所以甲烷的燃烧热的数值应大于a,故C错误;
D、苯环中的键是介于单键和双键之间的特殊的化学键,不能按单双键交替计算,故D错误;
故选:A.
B、燃烧热是1mol可燃物完全燃烧放出的热量,每种物质的燃烧热个定值,故B错误;
C、H燃烧生成液态水时才是燃烧热,所以甲烷的燃烧热的数值应大于a,故C错误;
D、苯环中的键是介于单键和双键之间的特殊的化学键,不能按单双键交替计算,故D错误;
故选:A.
点评:本题考查了汽化热、燃烧热、以及苯环中的特殊化学键,题目难度中等,平时学习中注意对基础知识的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在0.1mol?L-1的Na2CO3溶液中,下列关系正确的是( )
| A、c(Na+)=2c(CO32-) |
| B、c(OH-)=2c(H+) |
| C、c(HCO3-)>c(H2CO3) |
| D、c(Na+)<c(CO32-)+c(HCO3-) |
2006年10月16日美国与俄罗斯宣布,两国科学家合作成功合成了118号超重元素.对118号元素下列叙述合理的是( )
| A、它的最外层电子数是8 |
| B、它属于第VⅢ族 |
| C、它是活泼的金属元素 |
| D、它的中子数是118 |
 在我省盛大节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
在我省盛大节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A、S-诱抗素分子中含有苯环 |
| B、S-诱抗素分子中只含有极性键 |
| C、S-诱抗素分子中所有原子共面 |
| D、S-诱抗素属于烃的衍生物 |
关于蛋白质的叙述不正确的是( )
| A、结晶牛胰岛素是我国科学家1965年首次合成的具有生命活力的蛋白质 |
| B、重金属盐类能使蛋白质凝结变性,所以误食重金属盐能使人中毒 |
| C、在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,若再加水,也不溶解 |
| D、浓HNO3溅在皮肤上能使皮肤呈现黄色,是由于浓HNO3和蛋白质发生了颜色反应 |
通过化学反应不能生成( )
| A、新物质 | B、新能量 |
| C、新元素 | D、新分子 |
 ;一个Cl.则该有机物的同分异构体共有
;一个Cl.则该有机物的同分异构体共有